
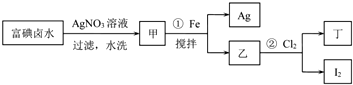
分析 实验一:富碘卤水中含有I-,加入硝酸银发生:Ag++I-═AgI↓,过滤水洗后的甲为AgI,加入Fe搅拌,可得Ag和FeI2,向其中通Cl2,发生2FeI2+3Cl2═2I2+2FeCl3,由于加入的Fe过量,所以先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液.分离I2和FeCl3溶液方法是加入苯、汽油、CCl4等有机溶剂进行萃取,以此解答该题;
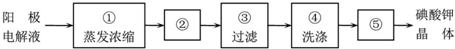
实验二:阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,阴极上氢离子放电生成氢气;
实验三:从热溶液中析出晶体的方法是冷却结晶;洗涤后的晶体要进行干燥;洗涤晶体的目的:洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
解答 解:(1)FeI2具有还原性,与充足的氯气发生氧化还原反应生成I2和FeCl3,反应的离子方程式为2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;
(2)由流程图可看出,副产物为Ag,由于加入的Fe过量,所以先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液,
故答案为:Ag;
(3)丁为FeCl3,分离I2和FeCl3溶液方法是加入苯、汽油、CCl4等有机溶剂进行萃取,
故答案为:萃取;
(4)阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,电极方程式为I-+6OH--6e-=IO3-+3H2O,阴极上氢离子放电生成氢气,所以阴极现象:有气泡产生,破坏水的电离平衡正向进行,溶液中氢氧根离子浓度增大,PH增大;
故答案为:2I--2e-=I2 或I-+6OH--6e-=IO3-+3H2O;变大;
(5)从热溶液中析出晶体的方法是:冷却结晶;洗涤后的晶体有水分,所以要进行干燥;过滤后得到的晶体上吸附部分氢氧化钾等杂质,为得到较纯净的碘酸钾晶体,所以要进行洗涤.
故答案为:冷却结晶;洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
点评 本题考查了碘的物理性质、电解原理、碘离子的检验等性质,难度不大,明确酸性条件下碘离子和碘酸根离子能生成碘单质,碱性条件下,碘能和氢氧根离子生成碘离子和碘酸根离子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.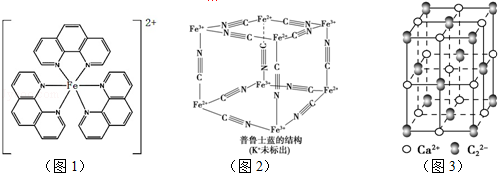
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )| A. | A点时c(CH3COO-)>c(Na+) | |
| B. | 室温时0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| HClO4 | H2SO4 | HCl | HNO3 | |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中高氯酸是这四种酸中最强的酸 | |
| B. | 在冰醋酸中硫酸的电离方程式为H2SO4═2H++SO42- | |
| C. | 在冰醋酸中这四种酸都没有完全电离 | |
| D. | 酸的强弱与其本身的结构和溶剂的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| B | AgCl沉淀中滴入稀KI溶液 | 有黄色沉淀出现 | AgI比AgCl更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 淀粉与稀H2SO4共热,再加银氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 错误 | 原因分析及改正 | |
| A | FeBr2溶液中通入少量Cl2的离子方程式: 2Br-+Cl2═Br2+2Cl- | 还原性强弱:Fe2+>Br-; 改正:2Fe2++Cl2=2Fe3++2Cl-. |
| B | 除去CO2中的HCl气体:通过饱合Na2CO3溶液,分离方法:洗气 | “饱合”应为“饱和”,Na2CO3不仅要吸收HCl气体,还要吸收CO2,应改用饱和NaHCO3溶液;分离方法:洗气. |
| C | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液.指示剂:甲基橙,终点判断:当滴至最后一滴标准液,溶液由黄色变为橙色,即达终点. | 指示剂不能用甲基橙,改用酚酞,终点判断:当滴至最后一滴标准液,溶液由红色变为浅红色,即达终点. |
| D | 双原子分子一定是非极性分子 | 双原子分子有可能为单质或化合物分子; 改正:双原子单质分子一定是非极性分子而双原子化合物分子一定是极性分子. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com