
| A. | 1:1 | B. | 1:2 | C. | 1:10 | D. | 10:1 |
分析 稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释500倍后,溶液中的SO42-的浓度成比例下降,但H+浓度降到10-7mol/L便不再下降.
解答 解:pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=5×10-6mol/L,
溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=1×10-8mol/L,
所以稀释后溶液中硫酸根离子与氢离子浓度之比为:1×10-8mol/L:1×10-7mol/L=1:10,
故选C.
点评 本题考查了溶液pH的计算方法,题目难度中等,注意掌握溶液中氢离子、氢氧根离子浓度与溶液pH的关系,明确酸溶液稀释后不可能变成碱溶液.


科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-H之间只是sp2形成的σ键,C-C之间只是未参加杂化的2p轨道形成的π键 | |
| B. | C-C间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| D. | sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
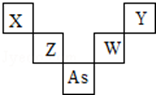 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A. | W的氧化物对应的水化物必是强酸 | |
| B. | X的原子半径比As原子半径小,两者原子序数之差为29 | |
| C. | Z的氧化物可与Y的氢化物水溶液不会发生化学反应 | |
| D. | 图中五种元素均是非金属元素,并且Y的非金属性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 2.0gH218O与D216O的混合物中所含中子数为NA | |
| C. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
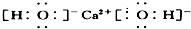
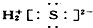

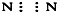

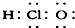
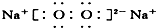
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
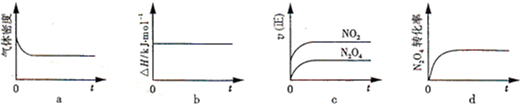
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com