
| A. | N2 和 CO | B. | CO2 和 N2O | C. | O3 和 CO2 | D. | CO32- 和 NO3- |
分析 根据题意:原子数相同,电子总数相同的分子,互称为等电子体,依据标在元素符号右下角的数字表示一个分子中所含原子的个数;如CO2 中含有3个原子,CO中含有2个原子,进行分析解答本题.
解答 解:A.N2、CO中原子数相同,N2电子总数为 7×2=14,CO中电子数为:6+8=14,故A不选;
B.CO2 和 N2O分子中原子数相同,电子数也相同,均是22个,B不选;
C.O3 和 CO2中原子数相同,电子数不相同,分别是24和22个,C选;
D.CO32- 和 NO3-中原子数相同,电子数均为32个,D不选;
故选C.
点评 本题考查“等电子原理”的应用,注意掌握原子组成与结构是解题的关键,题目难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与4 mol H2在一定条件下反应生成NH3的分子数为2NA | |
| B. | 标准状况下,5.6LSO3中含有的原子总数为NA | |
| C. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| D. | 常温下,4.6g NO2 和N2O4的混合物中氧原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
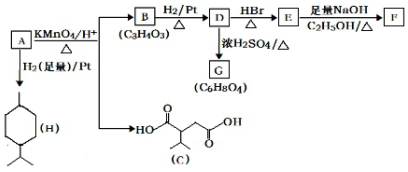
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$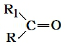 +R2COOH
+R2COOH .
.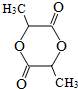 .
.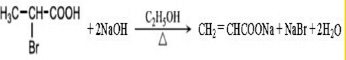 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
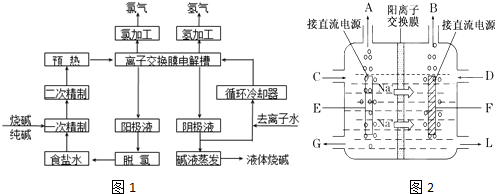
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++Cu=2Fe2++Cu2+成立说明氧化性:Fe3+>Cu2+ | |
| B. | 25℃,pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 5.6g铁与足量的氯气反应失去电子为0.2mol | |
| D. | 硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、NO3-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Cu2+、Na+、SO42-、OH- | D. | Ba2+、SO32-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
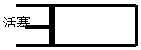 如图,标准状况下,向带有活塞最大容积为120L的密闭容器中充入a mol H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )
如图,标准状况下,向带有活塞最大容积为120L的密闭容器中充入a mol H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )| A. | 14.40 | B. | 8.00 | C. | 5.60 | D. | 2.86 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com