
 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
分析 (1)由题目信息可知,高锰酸钾溶液在酸性、碱性条件下都会分解,且见光分解速度加快,故应避光保存配成中性溶液;
(2)根据化合价升降方法,反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒、电荷守恒确定其它物质的系数;
(3)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)大催化效果更好;
(4)①高锰酸钾具有强氧化性,可以氧化碱式滴定管的橡皮管,故应用酸式滴定管盛放;
②逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加,防止高锰酸钾在酸性条件下分解;
③根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(待测)的影响,以此判断浓度的误差;
④高锰酸钾为紫色溶液,逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色为达到滴定终点;根据关系式:2MnO4-~5C2O42-计算.
解答 解:(1)由题目信息可知,高锰酸钾溶液在酸性、碱性条件下都会分解,且见光分解速度加快,故应盛放在棕色瓶中避光保存配成中性溶液;
故答案为:配成中性溶液并保存在棕色试剂瓶中;
(2)反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒可知Mn2+系数为2、CO2系数为10,根据电荷守恒可知H+系数为16,根据氢元素守恒可知H2O系数为8,配平后离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:2、5、16、2、10、8H2O;
(3)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)大催化效果更好,
故答案为:反应生成的Mn2+对反应有催化作用,且c(Mn2+)大催化效果更好;
(4)①高锰酸钾具有强氧化性,可以氧化碱式滴定管的橡皮管,故应用酸式滴定管盛放,故选择丙,
故答案为:丙;
②A.未润洗盛放KMnO4的滴定管,KMnO4溶液稀释,浓度偏少,消耗V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,所测KMnO4浓度偏低,故A正确;
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡,消耗V(待测)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,所测KMnO4浓度偏高,故B错误;
C.定容时,俯视刻度线,溶液的体积偏小,标准液的浓度偏大,消耗V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,所测KMnO4浓度偏低,故C正确;
D.锥形瓶用水洗之后未用待测液润洗,操作正确,无影响,故D错误;
故选AC.
③高锰酸钾为紫色溶液,逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色为达到滴定终点;
1.340g纯净的草酸钠中n(C2O42-)=$\frac{1.34g}{134g/mol}$=0.01mol,则:
2MnO4-~5C2O42-
2mol 5mol
c(MnO4-)×0.02L×10 0.01mol
解得c=0.0200mol/L,
故答案为:逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色;0.0200.
点评 本题考查氧化还原反应配平、氧化还原反应滴定应用、化学计算等,难度中等,注意把握实验的原理,需要学生具备一定的理论分析能力和计算解决问题的能力.


科目:高中化学 来源: 题型:解答题
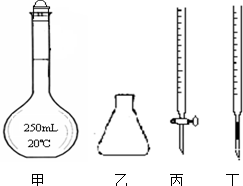
 ;
;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与乙酸发生酯化反应 | B. | 乙醇的催化氧化 | ||
| C. | 乙醇与钠反应生成氢气 | D. | 乙醇在浓硫酸存在下加热至170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出akJ/mol | ||
| 乙 | 1mol | 1mol | 放出bkJ/mol | ||
| 丙 | 2mol | 2mol | 放出ckJ/mol | ||
| 丁 | 3mol | 2mol | 吸收dkJ/mol |
| A. | c+d<Q | |
| B. | 平衡时,甲、丁容器中X、W的转化率之和大于1 | |
| C. | 平衡时丙容器中Z的物质的量浓度最大 | |
| D. | X的转化率为:甲<乙<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s区、d区、ds区都是金属元素 | |
| B. | p区都是主族元素 | |
| C. | 所有族中IIIB中元素种类最多 | |
| D. | 最外层电子数为2的元素都分布在s区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI>HBr>HCl>HF | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NaCl>NaBr>KBr | D. | 金刚石>碳化硅>晶体硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com