
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:分析 (1)①黄铜矿与空气反应生成Cu和Fe的低价硫化物:产物为Cu2S、FeS;部分Fe的硫化物转变为Fe的低价氧化物:产物为FeO;反射炉内生成炉渣的主要成分是FeSiO3;
②反射炉内生成炉渣的主要成分是FeSiO3;
(2)Cu2S被氧气氧化生成二氧化硫和Cu2O;Cu2O与Cu2S反应Cu和SO2;
(3)粗铜应该放在阳极,c是阳极;d是阴极,发生还原反应 Cu2++2e-=Cu;粗铜中的Au、Ag、,它们在电解槽中的下方,以单质形式沉积在c(阳极)下方;Fe以Fe2+的形式进入电解液中.
解答 解:(1)①黄铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2 $\frac{\underline{\;高温\;}}{\;}$2FeO+2SO2;
故答案是:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2;FeS+3O2 $\frac{\underline{\;高温\;}}{\;}$2FeO+2SO2;
②二氧化硅在高温下与FeO反应生成FeSiO3,所以生成炉渣的主要成分为:FeSiO3,故答案为:FeSiO3;
(2)Cu2S被氧气氧化生成二氧化硫和Cu2O:2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+2SO2↑,
故答案是:2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+2SO2↑;
(3)①c连电源正极,d连电源的负极;故c为阳极,d为阴极;粗铜板应放在阳极,即c;故答案为:c;
②d阴极发生还原反应,阴极上铜离子得电子生成Cu,则方程式为:Cu2++2e-=Cu;故答案为:Cu2++2e-=Cu;
③Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
故答案为:Au、Ag以单质形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中.
点评 本题考查了物质的制备流程、铜及其化合物的性质、以及电解原理的应用,题目难度中等,侧重于考查学生阅读信息、处理信息的能力,明确物质之间的反应以及电解池的原理是解题的关键.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 | |
| B. | 第2周期元素从Li到F,得电子能力逐渐增强 | |
| C. | 元素原子的最外层电子数等于元素的最高正化合价 | |
| D. | O与S为同主族元素,且O比S的得电子能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
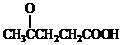 )合成聚芳酯E的路线:
)合成聚芳酯E的路线: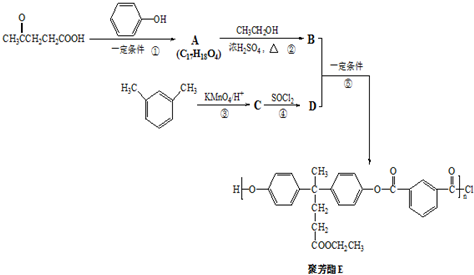
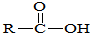 →
→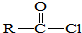 +SO2+HCl
+SO2+HCl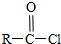 +R′OH→
+R′OH→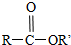 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)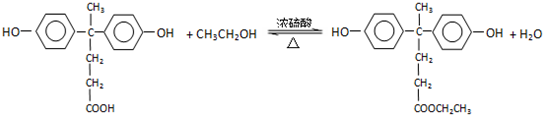 .
.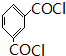 .
.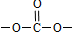 结构 ④苯环上只有2个取代基在上述同分异构体中,写出其中任一种与足量NaOH溶液共热反应的化学方式:
结构 ④苯环上只有2个取代基在上述同分异构体中,写出其中任一种与足量NaOH溶液共热反应的化学方式: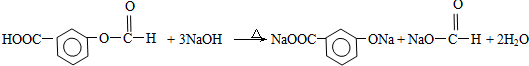 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大,主要原因是增加了反应物分子浓度 | |
| D. | 使用正催化剂能增大活化分子百分数,从而显著地增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
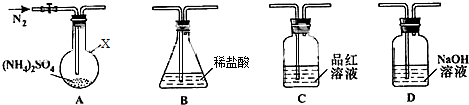
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| C. | 用蒸发结晶的方法从氧化后的海带灰浸取液中提取碘--蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com