
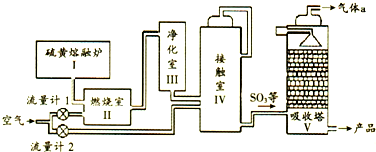
| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)?SO3(g)△H=-297kJ•mol-1S(s)+O2(s)=SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2(s) $?_{△}^{催化剂}$SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
分析 A.在Ⅰ中硫黄已经为熔融状态,反应热与聚集状态有关;
B.二氧化硫、氧气在接触室Ⅳ内在催化剂条件件下发生催化氧化生成三氧化硫;
C.催化剂的使用能够提高反应速率不能引起化学平衡的移动;
D.Ⅴ中含有二氧化硫,二氧化硫有毒;
解答 解:A.在Ⅰ中硫黄已经为熔融状态,所以Ⅱ中的热方程式是:S(l)+O2(g)?SO3(g)△H=-297kJ•mol-1,故A错误;
B.二氧化硫、氧气在接触室Ⅳ内在催化剂条件件下发生催化氧化生成三氧化硫,方程式:2SO2+O2(s)$?_{△}^{催化剂}$SO3,故B正确;
C.选项Ⅳ过程中加催化剂只能同等程度加快反应速率,化学平衡不移动,不能提高物质的平衡转化率,故C错误;
D.Ⅴ中含有二氧化硫,二氧化硫有毒,直接排放到空气中能够引起空气污染,应进行尾气处理,故D错误;
故选:B.
点评 本题以浓硫酸的工业制备流程为载体,考查了热化学方程式的书写、化学反应速率、化学平衡的影响因素,侧重考查学生分析问题能力,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 明矾投入水中的电离方程式为:KAI(SO4)2•12H2O=K++Al3++2SO42-+12H20,说明明矾是一种混合物 | |
| B. | 净水时Al3+发生水解生成的是Al(OH)3沉淀 | |
| C. | 明矾净水的原理是杀菌消毒 | |
| D. | 硫酸铁可以代替明矾进行净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
 ,O=C=O.
,O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
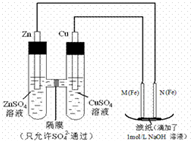 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
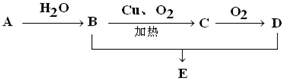 如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.
如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 坐标对应点 | a | b | c | d |
| n(SO32-):n(HSO32-) | / | 91:9 | 1:1 | 9:91 |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
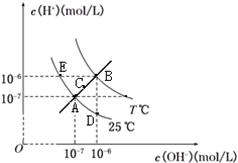
| A. | 图中五点KW间关系:B>C>A=D=E | |
| B. | E点对应的水溶液中,可能有NH${\;}_{4}^{+}$、Ba2+、Cl-、I-、K大量同时存在 | |
| C. | 若处在B点时,将pH=3的硫酸溶液与pH=9的KOH溶液等体积混合,所得溶液呈中性 | |
| D. | 若0.1mol/L的NaHB溶液中c(OH+)与c(OH-)关系如图D点所示,则溶液中有:c(HB-)>c(OH-)>c(B2-)>c(H2B) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+<S2-<Cl-<K+ | B. | 还原性:I-<Br-<-Cl<F- | ||
| C. | 稳定性:SiH4<PH3<HCl<HBr | D. | 溶解性:BaO4<CaSO4<MgSO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe2+、NO3-、SO42-、I- | |
| B. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液中:Na+、I-、K+、NO3- | |
| D. | c(H+)=10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com