
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种可充电锂电池,反应原理是4Li+FeS2 ![]() Fe+2Li2S,LiPF6 是电解质,SO(CH3 )2 是溶剂。下列说法正确的是( )
Fe+2Li2S,LiPF6 是电解质,SO(CH3 )2 是溶剂。下列说法正确的是( )

A. 放电时,a 极被还原
B. 放电时,电解质溶液中 PF6- 向 b 极区迁移
C. 充电时,b 极反应式为Fe+2Li2S-4e-=FeS2+4Li+
D. 充电时,a 极连接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3-
C.c(Fe3+)=0.1 mol·L-1的溶液:H+、Al3+、Cl-、SCN-
D.![]() =0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJB.2953kJC.3236kJD.3867kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二砷,俗称砒霜,分子式![]() ,是最古老的毒物之一,某含砷元素(
,是最古老的毒物之一,某含砷元素(![]() )的工业废水经如图所示流程转化为粗
)的工业废水经如图所示流程转化为粗![]() 。
。
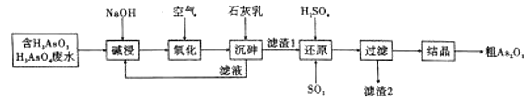
(1)“碱浸”时发生的反应有:![]() ;
;![]() 。其目的是将废水中的
。其目的是将废水中的![]() 和
和![]() 转化为盐,其中
转化为盐,其中![]() 的化学名称为___________________。
的化学名称为___________________。
(2)“通入空气氧化”时,![]() 转化为
转化为![]() 时反应转移的电子数为______NA。
时反应转移的电子数为______NA。
(3)“沉砷”是将元素转化为![]() 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:
a.![]()
b.![]()
“沉砷”时加人少量稀盐酸,________(填“有利于”或“不利于”)砷元素转化为![]() 沉淀,简述原因:__________________________________。
沉淀,简述原因:__________________________________。
(4)“还原”过程中![]() 转化为
转化为![]() ,反应的化学方程式是_________________________。
,反应的化学方程式是_________________________。
(5)“还原”后过滤所得滤渣2为__________(填化学式),![]() 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成![]() 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入![]() ,溶液中制备
,溶液中制备![]() 溶胶,写出制取
溶胶,写出制取![]() 溶胶的化学方程式:_____________________________________。已知:
溶胶的化学方程式:_____________________________________。已知:![]() 对其聚沉能力较强,
对其聚沉能力较强,![]() 对其聚沉能力较弱,则
对其聚沉能力较弱,则![]() 胶粒带__________(填“正电荷”或“负电荷”)。
胶粒带__________(填“正电荷”或“负电荷”)。
(6)确定物质中是否含有砒霜,常用马氏试砷法。其原理是在含砒霜的物质中加入![]() 和稀
和稀![]() ,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2SO4溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。下列说法正确的是( )
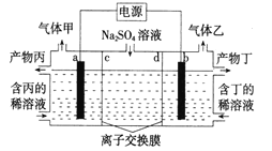
A.b 极与电源的正极相连
B.产物丙为NaOH 溶液
C.离子交换膜d 为阴离了交换膜(允许阴离子通过)
D.a 电极反应式为2H2O-4e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com