
”¾ĢāÄæ”æÓŠ¶¾ĘųĢåµÄ¼õÅÅŗĶ“¦ĄķŹĒ¹¤ŅµÉś²śÖŠµÄÖŲŅŖæĪĢā”£
£Ø1£©Na2CO3ČÜŅŗæÉĪüŹÕĪ²ĘųSO2,·“Ó¦¹ż³ĢÖŠČÜŅŗ×é³É±ä»ÆČēĻĀĶ¼”£

¢ŁSO2·Ö×ÓŹōÓŚ________ (Ń”Ģī”°¼«ŠŌ”±»ņ”°·Ē¼«ŠŌ”±) ·Ö×Ó£¬ŅŌÉĻ·“Ó¦_____(Ń”Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±) ĖµĆ÷S”¢CĮ½ÖÖŌŖĖŲµÄ·Ē½šŹōŠŌĒæČõ”£
¢ŚAµć·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ_____”£
£Ø2£©Ęū³µ·¢¶Æ»śĻ”Č¼æŲÖĘĻµĶ³Ö÷ŅŖ¹¤×÷ŌĄķŹĒ·¢¶Æ»śŌŚĻ”Č¼ŗĶø»Č¼Ģõ¼žĻĀ½»Ģę½ųŠŠ£¬Ī²ĘųÖŠµÄNOxŌŚ“߻ƼĮÉĻ·“Ó¦ĶŃ³ż”£Ę乤×÷ŌĄķŹ¾ŅāĶ¼ČēĻĀ:

¢ŁŅŃÖŖBa(NO3)2·Ö½ā²śĪļŗ¬ÓŠĮ½ÖÖĘųĢ壬ÓÉÉĻĶ¼ŠÅĻ¢£¬Š“³öBa(NO3)2·Ö½ā·“Ó¦µÄ»Æѧ·½³ĢŹ½_______”£
¢ŚĻĀĮŠĖµ·ØÕżČ·µÄŹĒ__________
A.Ļ”Č¼¹ż³ĢµÄÄæµÄŹĒ¹ĢµŖ
B.ŌŚÕūøö¹ż³ĢÖŠ£¬PtŗĶBaO¶¼æÉæ“×÷“߻ƼĮ
C.Ęū³µĪ²ĘųČō²»“¦Ąķ£¬ĘäÖŠµÄµŖŃõ»ÆĪļµČæÉÄÜŠĪ³É¹ā»ÆѧŃĢĪķ
D.ø»Č¼¹ż³ĢÖŠ£¬NO2ÓėCO·“Ó¦£¬Ńõ»Æ²śĪļŗĶ»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ1:1
¢ŪŹµŃé²ā³ö£¬ĆæĒ§æĖCxHy (ŅŌŅŗĢåC8H18ĪŖĄż) ŌŚO2ÖŠ³ä·ÖČ¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö4.78”Į104kJČČĮ攣Š“³öC8H18Č¼ÉÕČȵÄČČ»Æѧ·“Ó¦·½³ĢŹ½______________”£
£Ø3£©ÄņĖŲæÉÓĆÓŚŹŖ·ØŃĢĘųĶѵŖ¹¤ŅÕ£¬Ęä·“Ó¦ŌĄķĪŖ:
NO+NO2+ H2O =2HNO2 2HNO2+CO(NH2)2=2N2ӟ+CO2ӟ+3H2Oӣ
¢ŁĻĀĶ¼ŹĒÄņĖŲŗ¬Įæ¶ŌĶѵŖŠ§ĀŹµÄÓ°Ļģ£¬“Ó¾¼ĆŅņĖŲÉĻæ¼ĀĒ£¬Ņ»°ćŃ”ŌńÄņĖŲÅضČŌ¼ĪŖ_______%”£
¢Śµ±ŃĢĘųÖŠNO”¢NO2°“ÉĻŹö·“Ó¦ÖŠĻµŹż±ČŹ±ĶѵŖŠ§¹ū×ī¼Ń”£ČōŃĢĘųÖŠV(NO):V(NO2)=5 :3Ź±£¬æÉĶØČėŅ»¶ØĮæµÄæÕĘų£¬Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬V(æÕĘų): V(NO)=___________ (æÕĘųÖŠŃõĘųµÄĢå»żŗ¬Įæ“óŌ¼ĪŖ20%)”£

”¾“š°ø”æ ¼«ŠŌ ²»ÄÜ 2CO32-+SO2+H2O=2HCO3-+ SO32- 2Ba(NO3)2![]() 2BaO+O2”ü+4NO2”ü BC C8H18(l)+ 12.5O2(g)= 8CO2(g)+9H2O(l) ¦¤H=-5449.2kJ/mol 6 1:2
2BaO+O2”ü+4NO2”ü BC C8H18(l)+ 12.5O2(g)= 8CO2(g)+9H2O(l) ¦¤H=-5449.2kJ/mol 6 1:2
”¾½āĪö”æ£Ø1£©¢ŁSO2·Ö×ÓÖŠµÄS²ÉÓĆsp2ŌӻƹģµĄÓėO³É¼ü£¬SO2·Ö×Ó¹¹ŠĶŹĒVŠĪ£¬ĖłŅŌSO2·Ö×ÓŹōÓŚ¼«ŠŌ·Ö×Ó£¬ŅŌÉĻ·“Ó¦²»ŹĒÓĆĮņĖįÓėĢ¼ĖįÄĘ·“Ó¦µÄ£¬ĖłŅŌ²»ÄÜÖ¤Ć÷S”¢CĮ½ÖÖŌŖĖŲµÄ·Ē½šŹōŠŌĒæČõ”£¢ŚÓÉĶ¼æÉÖŖ£¬Aµć¶ŌÓ¦µÄĢ¼ĖįÄĘÅضČ×īµĶ”¢Ģ¼ĖįĒāÄĘÅضČ×īøߣ¬ĖłŅŌ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ2CO32-+SO2+H2O=2HCO3-+ SO32-”£
£Ø2£©¢ŁÓÉĢāŅā¼°ÉĻĶ¼ŠÅĻ¢æÉÖŖ£¬Ba(NO3)2·Ö½āĪŖŃõ»Æ±µ”¢O2ŗĶNO2£¬ Ba(NO3)2·Ö½ā·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2Ba(NO3)2![]() 2BaO+O2”ü+4NO2”ü ”£¢ŚA.Ļ”Č¼¹ż³ĢµÄÄæµÄŹĒĪŖĮĖ¼õÉŁĘū³µĪ²ĘųÖŠNOŗĶCOµÄŗ¬Į棬A²»ÕżČ·£»B.ŌŚÕūøö¹ż³ĢÖŠ£¬PtŗĶBaO¶¼æÉæ“×÷“߻ƼĮ£¬BÕżČ·£»C.Ęū³µĪ²ĘųČō²»“¦Ąķ£¬ĘäÖŠµÄµŖŃõ»ÆĪļµČæÉÄÜŠĪ³É¹ā»ÆѧŃĢĪķ£¬CÕżČ·£»D.ø»Č¼¹ż³ĢÖŠ£¬NO2ÓėCO·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2NO2 + 4CO == N2 + 4CO2£¬Ńõ»Æ²śĪļŗĶ»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ4:1£¬D²»ÕżČ·”£ĖłŅŌĖµ·ØÕżČ·µÄŹĒBC ”£¢ŪŹµŃé²ā³ö£¬ĆæĒ§æĖCxHy (ŅŌŅŗĢåC8H18ĪŖĄż) ŌŚO2ÖŠ³ä·ÖČ¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö4.78”Į104kJČČĮ棬ÓÉ“ĖĒó³ö1mol C8H18ĶźČ«Č¼ÉÕæÉŅŌ·Å³ö5449.2kJµÄČČĮ棬ĖłŅŌC8H18Č¼ÉÕČȵÄČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖC8H18(l)+ 12.5O2(g)= 8CO2(g)+9H2O(l) ¦¤H=-5449.2kJ/mol ”£
2BaO+O2”ü+4NO2”ü ”£¢ŚA.Ļ”Č¼¹ż³ĢµÄÄæµÄŹĒĪŖĮĖ¼õÉŁĘū³µĪ²ĘųÖŠNOŗĶCOµÄŗ¬Į棬A²»ÕżČ·£»B.ŌŚÕūøö¹ż³ĢÖŠ£¬PtŗĶBaO¶¼æÉæ“×÷“߻ƼĮ£¬BÕżČ·£»C.Ęū³µĪ²ĘųČō²»“¦Ąķ£¬ĘäÖŠµÄµŖŃõ»ÆĪļµČæÉÄÜŠĪ³É¹ā»ÆѧŃĢĪķ£¬CÕżČ·£»D.ø»Č¼¹ż³ĢÖŠ£¬NO2ÓėCO·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2NO2 + 4CO == N2 + 4CO2£¬Ńõ»Æ²śĪļŗĶ»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ4:1£¬D²»ÕżČ·”£ĖłŅŌĖµ·ØÕżČ·µÄŹĒBC ”£¢ŪŹµŃé²ā³ö£¬ĆæĒ§æĖCxHy (ŅŌŅŗĢåC8H18ĪŖĄż) ŌŚO2ÖŠ³ä·ÖČ¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö4.78”Į104kJČČĮ棬ÓÉ“ĖĒó³ö1mol C8H18ĶźČ«Č¼ÉÕæÉŅŌ·Å³ö5449.2kJµÄČČĮ棬ĖłŅŌC8H18Č¼ÉÕČȵÄČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖC8H18(l)+ 12.5O2(g)= 8CO2(g)+9H2O(l) ¦¤H=-5449.2kJ/mol ”£
£Ø3£©¢ŁÓÉĶ¼æÉÖŖ£¬µ±ÄņĖŲÅØ¶Č“óÓŚ6%Ź±£¬ĶѵŖŠ§ĀŹŌö¼ÓµÄ²¢²»Ć÷ĻŌ·“¶ųŌö¼ÓĮĖŌĮĻµÄĶ¶Čė£¬ĖłŅŌ“Ó¾¼ĆŅņĖŲÉĻæ¼ĀĒ£¬Ņ»°ćŃ”ŌńÄņĖŲÅضČŌ¼ĪŖ6%.
¢Śµ±ŃĢĘųÖŠNO”¢NO2°“ÉĻŹö·“Ó¦ÖŠĻµŹż±Č1:1Ź±ĶѵŖŠ§¹ū×ī¼Ń”£ČōŃĢĘųÖŠV(NO):V(NO2)=5 :3Ź±£¬ÉčNOŗĶNO2µÄĢå»ż·Ö±šĪŖ5LŗĶ3L£¬ŌņŠčŅŖ°Ń1L NO×Ŗ»ÆĪŖNO2²ÅĀś×ćĮ½ÕßĢå»ż±Č1:1µÄ¹ŲĻµ£¬ÓÉ2NO+O2=2NO2æÉÖŖ£¬Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬1L NOŠčŅŖ0.5LO2£¬æÕĘųÖŠŃõĘųµÄĢå»żŗ¬Įæ“óŌ¼ĪŖ20%£¬ŌņŠčŅŖ2.5LæÕĘų£¬ĖłŅŌV(æÕĘų): V(NO)=2.5:5= 1:2 ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹ·ÖĄąÕżČ·µÄŹĒ£Ø £©
A.Ä«Ė®”¢µ°°×ÖŹČÜŅŗ¾łŹōÓŚ½ŗĢåB.H2O”¢CO2¾łĪŖµē½āÖŹ
C.NO”¢SO3¾łĪŖĖįŠŌŃõ»ÆĪļD.H2S”¢O2³£×÷»¹Ō¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§°“Ķ¼ĖłŹ¾µÄ×°ÖĆ½ųŠŠµē½āŹµŃ锣ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
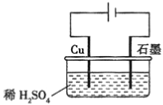
A. µē½ā¹ż³ĢÖŠ£¬Ķ¼«ÉĻÓŠH2Éś³É
B. µē½ā³õĘŚ£¬Ö÷·“Ó¦·½³ĢŹ½ĪŖ£ŗ2H2O=H2”ü+O2”ü
C. Õūøöµē½ā¹ż³ĢÖŠ£¬H+µÄÅØ¶Č²»¶ĻŌö“ó
D. µē½āŅ»¶ØŹ±¼äŗó£¬ŹÆÄ«µē¼«ÉĻÓŠĶĪö³ö
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ¢ŁH2(g)+ ![]() O2(g)=H2O(g)£»¦¤H1= akJ”¤mol-1
O2(g)=H2O(g)£»¦¤H1= akJ”¤mol-1
¢Ś2H2(g)+O2(g) = 2H2O(g)£»¦¤H2= b kJ”¤mol-1 ¢Ū H2(g)+ ![]() O2(g)=H2O(l)£»¦¤H3= c kJ”¤mol-1
O2(g)=H2O(l)£»¦¤H3= c kJ”¤mol-1
¢Ü2H2(g)+O2(g) = 2H2O(l)£»¦¤H4= d kJ”¤mol-1£¬ĻĀĮŠ¹ŲĻµŹ½ÖŠÕżČ·µÄŹĒ£Ø £©
A. 2a=b<0 B. b>d>0 C. a<c<0 D 2c=d>0
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A. ŌŚ±ź×¼×“æöĻĀ,1 molĖ®µÄĢå»żŹĒ22£®4 L
B. 1 mol H2ĖłÕ¼µÄĢå»żŌ¼ĪŖ22£®4 L
C. ŌŚ±ź×¼×“æöĻĀ, °¢·ü¼ÓµĀĀŽ³£Źżøö·Ö×ÓĖłÕ¼µÄĢå»żŌ¼ĪŖ22£®4 L
D. ŌŚ±ź×¼×“æöĻĀ,1 mol NH3ŗĶCO»ģŗĻĘųĢåĖłÕ¼µÄĢå»żŌ¼ĪŖ22£®4 L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆ“æ¾»µÄŠæĮ£ÓėĻ”ŃĪĖį·“Ó¦ÖĘČ”ĒāĘųĘųĢ壬Ēė»Ų“š£ŗ
£Ø1£©ŹµŃé¹ż³ĢČēĻĀĶ¼ĖłŹ¾£¬·ÖĪöÅŠ¶Ļ¶Ī»Æѧ·“Ó¦ĖŁĀŹ×īæģ£¬¶ĪŹÕ¼ÆµÄĒāĘų×ī¶ą£® 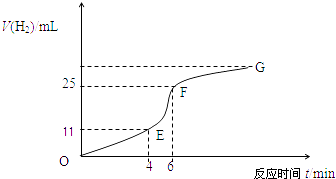
£Ø2£©½«ŠæĮ£Ķ¶ČėŹ¢ÓŠĻ”ŃĪĖįµÄÉÕ±ÖŠ£¬øÕæŖŹ¼Ź±²śÉśH2µÄĖŁĀŹÖš½„¼Óæģ£¬ĘäÓ°ĻģŅņĖŲŹĒ £¬ Ņ»¶ØŹ±¼äŗó·“Ó¦ĖŁĀŹÖš½„¼õĀż£¬ĘäŌŅņŹĒ £®
£Ø3£©ĪŖĮĖ¼õ»ŗÉĻŹö·“Ó¦µÄĖŁĀŹ£¬ÓūĻņČÜŅŗÖŠ¼ÓČėĻĀĮŠĪļÖŹ£¬ÄćČĻĪŖæÉŠŠµÄŹĒ
A.ÕōĮóĖ®
B.ĀČ»ÆÄĘ¹ĢĢå
C.ĀČ»ÆÄĘČÜŅŗ
D.ÅØŃĪĖį
E.½µµĶĪĀ¶Č
£Ø4£©EF¶Ī²śÉśH2µÄ·“Ó¦ĖŁĀŹĪŖmLmin©1 £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌĀĮĶĮæó(Ö÷ŅŖ³É·ÖĪŖAl2O3,ŗ¬SiO2ŗĶFe2O3µČŌÓÖŹ)ĪŖŌĮĻÉś²śĀĮŗĶµŖ»ÆĀĮµÄŅ»ÖÖ¹¤ŅÕĮ÷³ĢČēĻĀ”¾ŅŃÖŖ:SiO2ŌŚ”°¼īČÜ”±Ź±×Ŗ»ÆĪŖĀĮ¹čĖįÄĘ(NaAlSiO4”¤nH2O)³Įµķ”攣

£Ø1£©²Ł×÷I”¢¢ņµÄĆū³ĘĪŖ____________”£
£Ø2£©ÓĆŃõ»ÆĪļµÄŠĪŹ½±ķŹ¾ĀĮ¹čĖįÄʵĻÆѧŹ½_____________”£
£Ø3£©ČÜŅŗaÖŠ¼ÓČėNaHCO3ŗó£¬Éś³É³ĮµķµÄĄė×Ó·½³ĢŹ½ĪŖ____________”£
£Ø4£©Al2O3±ČĮķĶāŅ»ÖÖĀĮµÄ»ÆŗĻĪļAlCl3ČŪµćøß³öŗܶą£¬ŌŅņŹĒ_________;ÓŠČĖæ¼ĀĒÓĆČŪČŚĢ¬AlCl3µē½āÖʱøĀĮ£¬Äć¾õµĆŹĒ·ńæÉŠŠ£¬____(Ń”Ģī”°æÉŠŠ”±»ņ”°²»æÉŠŠ”±)£¬ŹŌ·ÖĪöŌŅņ_________”£
£Ø5£©Č”Ņ»¶ØĮæµÄѳʷ£¬ÓĆŅŌĻĀ×°ÖĆ²ā¶Øѳʷ֊AlNµÄ“æ¶Č(¼Š³Ö×°ÖĆŅŃĀŌČ„)”£“ņæŖK2,¼ÓČėNaOHÅØČÜŅŗ£¬ÖĮ²»ŌŁ²śÉśNH3”£“ņæŖK1,ĶØČėN2Ņ»¶ĪŹ±¼ä”£

¢ŁŹµŃéÖŠŠčŅŖ²ā¶ØµÄŹż¾ŻŹĒ___________”£
¢ŚÓÉӌװÖĆ“ęŌŚČ±ĻŻ£¬µ¼ÖĀ²ā¶Ø½į¹ūĘ«øߣ¬ĒėĢį³öøĽų·½·Ø:___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”抓³öĻĀĮŠ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ
£Ø1£©N2ŗĶH2·“Ӧɜ³É34g NH3£¬·Å³ö92kJČČĮæ____________________”£
£Ø2£©1molCH4(g)ŌŚO2ÖŠĶźČ«Č¼ÉÕÉś³ÉCO2ŗĶH2O(g)£¬·Å³ö890£®3kJČČĮæ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµ°°×ÖŹŹĒČĖĢåĖłŠčµÄÖŲŅŖÓŖŃųĪļÖŹ£¬ĘäÖŠ²»ŗ¬ĻĀĮŠÄÄÖÖŌŖĖŲ£Ø £©
A.NB.SiC.OD.C
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com