
| A.石灰水 | B.酚酞溶液 | C.BaCl2溶液 | D.品红溶液 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.SO2能使品红溶液褪色是因为SO2具有氧化性,所以它也能使酸碱指示剂褪色 |
| B.硫化氢中硫显最低价态-2价,因此只具有还原性 |
| C.浓硫酸使木棒或棉花变黑,体现了浓硫酸的吸水性 |
| D.BaSO4可作“钡餐”进行X射线检查 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
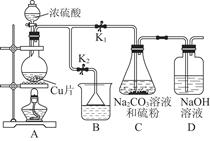
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 | | | | |
| 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入BaCl2溶液中,有白色沉淀生成 | B.通入FeCl3溶液中,有SO42-生成 |
| C.通入氯水中,有淡黄色沉淀生成 | D.通入KI溶液中,有I2生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.湿润的蓝色石蕊试纸先变红后褪色 |
| B.左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2能使蓝色石蕊试纸先变红后褪色 |
| B.SO2能使沾有KMnO4溶液的滤纸褪色,证明了SO2具有还原性 |
| C.SO2能使品红试纸褪色,证明了SO2的漂白性 |
| D.SO2能使沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
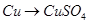
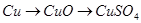
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com