

分析 图甲制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连为阳极,则a为铁电极,电极反应式为:Fe-2e-=Fe2+,与溶液中的氢氧根离子生成Fe(OH)2沉淀,电解液为氢氧化钠,b为阴极,水中的氢离子放电,电极反应式为:2H2O+2e-=2OH-+H2↑,
图甲制纯净的Fe(OH)2沉淀,工业级NaOH与电源正极连接,作阳极,由水中的氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,钠离子通过阳离子交换膜进入乙池,纯NaOH溶液从乙出口流出.
解答 解:(1)由分析可知电解液c为氢氧化钠溶液;
故答案为:A;
(2)a与电源正极相连为阳极,制备Fe(OH)2沉淀,则Fe为阳极,故a电极为铁,b为阴极,水中的氢离子放电,电极反应式为:2H2O+2e-=2OH-+H2↑;
故答案为:Fe;2H2O+2e-=2OH-+H2↑;
(3)适当缩小a、b之间的距离、适当增加电源的电压可在较短的时间内看到Fe(OH)2白色沉淀;
故答案为:AB;
(4)①工业级NaOH与电源正极连接,作阳极,由水中的氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑;
故答案为:4OH--4e-=2H2O+O2↑;
②工业级NaOH与电源正极连接,作阳极,由水中的氢氧根离子放电,溶液中阳离子剩余,钠离子通过阳离子交换膜进入乙池,纯NaOH溶液从乙出口流出;
故答案为:乙.
点评 本题考查电解池知识,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
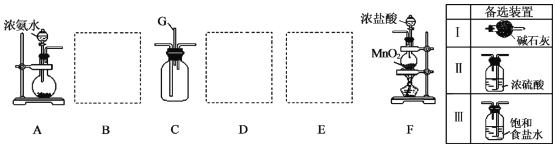
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
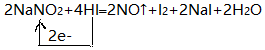 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
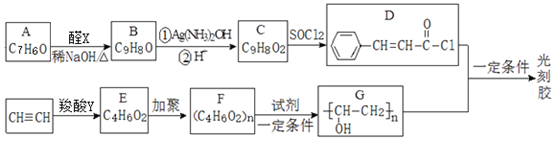
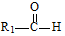 +
+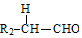 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$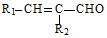 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)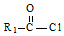 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$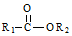 +HCl(R1,R2为烃基)
+HCl(R1,R2为烃基) .
. .
.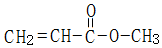
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
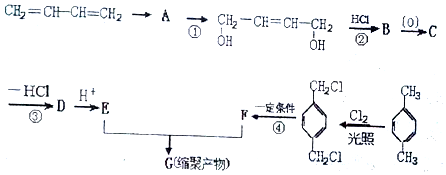
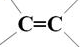 、-COOH.
、-COOH. .
.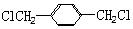 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
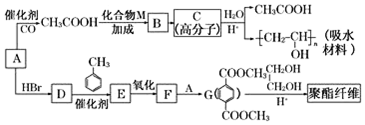
 .
. 合成
合成  的流程图(注明反应条件)
的流程图(注明反应条件) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
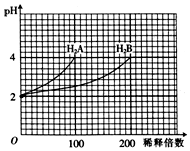 常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )
常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )| A. | H2A的电离方程式为H2A?H++HA-、HA-?H++A2- | |
| B. | pH=4的NaHA水溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| C. | 含NaHA、NaHB的混合溶液中,各离子浓度关系为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) | |
| D. | NaHB水溶液中,各离子浓度的大小顺序为c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
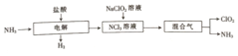
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com