
| A、熵变小于零而焓变大于零的反应肯定不能发生 |
| B、热化学方程式中△H的值与反应物的用量有关 |
| C、化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 |
| D、用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
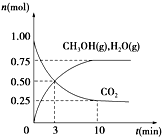 (1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.
(1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 9 |
| 4 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A、反应开始时,丙中的反应速率最快,乙中的反应速率最慢 |
| B、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
| C、平衡时,甲中和丙中H2的转化率均是60% |
| D、平衡时,乙中CO2的转化率大于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- |
| B、某溶液中先滴加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中有SO42- |
| C、某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ |
| D、某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中,三种金属中有两种金属过量 |
| B、参加反应的金属Na、Mg、Al的物质的量之比为6:3:2 |
| C、镁的物质的量为0.1mol |
| D、V=2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com