
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________________________________________________。
(2)混合气体的平均摩尔质量是_____________________________________________。
(3)CO2和CO的体积之比是____________________________________________________。
(4)CO的体积分数是_________________________________________________。
(5)CO2和CO的质量之比是_____________________________________________________。
(6)CO的质量分数是____________________________________________________。
(7)混合气体中所含氧原子的物质的量是_____________________________________。
(8)混合气体中所含碳原子的物质的量是___________________________________________。
答案 (1)1.339 g·L-1 (2)30 g·mol-1 (3)1∶7 (4)87.5% (5)11∶49 (6)81.7% (7)0.562 5 mol (8)0.5 mol
解析 (1)密度=质量/体积=15 g/11.2 L≈1.339 g·L-1。
(2)解法一:n=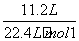 =0.5 mol,M=m/n=15 g/0.5 mol=30 g·mol-1。
=0.5 mol,M=m/n=15 g/0.5 mol=30 g·mol-1。
解法二:M=ρ·Vm=1.339 g·L-1×22.4 L·mol-1=30 g·mol-1。
(3)根据阿伏加德罗定律:体积之比=物质的量之比,最简单的方法是用十字交叉法计算:
30CO2 44228 CO14
n(CO2)/n(CO)=1/7。
(4)CO的体积分数=CO的物质的量分数=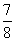 ×100%=87.5%。
×100%=87.5%。
(5)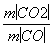 =
= =
= =11∶49。
=11∶49。
(6)CO的质量分数=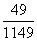 ×100%≈81.7%。
×100%≈81.7%。
(7)n(O)=2n(CO2)+n(CO)=2×0.5 mol×1/8+0.5 mol×7/8=0.562 5 mol。
(8)n(C)=n(CO2)+n(CO)=0.5 mol。


科目:高中化学 来源: 题型:
扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:
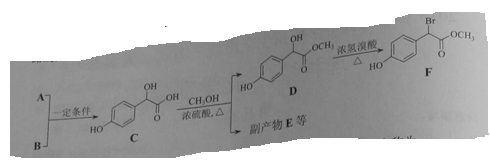
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________,写出A+B→C的化学反应方程式为__________________________.
(2) 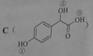 中①、②、③3个—OH的酸性有强到弱的顺序是:_____________。
中①、②、③3个—OH的酸性有强到弱的顺序是:_____________。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有________种。
(4)D→F的反应类型是__________,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:________mol .
写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:______
①、属于一元酸类化合物,②、苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
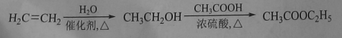
查看答案和解析>>
科目:高中化学 来源: 题型:
最近材料科学家研究发现了首例带结晶水的晶体在5 K下呈现超导性。据报道,该晶体的化学式为Na0.35CoO2·1.3H2O。若用NA表示阿伏加德罗常数,试计算12.2 g该晶体中含氧原子数______________,氢原子的物质的量____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种元素原子的质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A.由已知信息可得NA=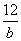
B.W g该原子的物质的量一定是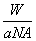 mol
mol
C.W g该原子中含有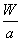 个该原子
个该原子
D.该原子的摩尔质量是aNA g
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol N2与足量的H2反应,转移的电子数是0.6NA
B.常温下,0.1 mol·L-1 NH4NO3溶液中含有的氮原子数是0.2NA
C.常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA
D.2.24 L CO和CO2的混合气体中所含的碳原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L的密闭容器中进行反应N2(g) + 3H2(g) 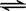 2NH3(g),2 min末N2的物质的量由20 mol减小到8 mol,则2 min末N2的反应速率为
2NH3(g),2 min末N2的物质的量由20 mol减小到8 mol,则2 min末N2的反应速率为
A.1.2 mol/(L·min) B.1 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
右图曲线a表示放热反应X(g)+Y(g)  Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b
Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b
曲线进行,可采取的措施是
A、升高温度 B、加大X的投入量
C、加催化剂 D、增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
向某一容积为5 L的密闭容器中,加入 0.2 mol CO和0.2 mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g) 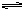 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
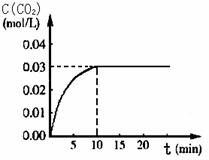
(1)由图中数据可知,反应从开始至达到平衡时,CO的化学反应速率v(CO)= ; H2的物质的量浓度c(H2)=_____________;该温度下此反应的平衡常数K= 。
(2)判断该反应是否达到平衡状态的依据是________________(填序号)。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为0
(3)若开始时向该容器中加入CO、H2O(g)、CO2和H2各0.1 mol,在相同条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2RCH2CHO CH2CHRCRCHO
CH2CHRCRCHO
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
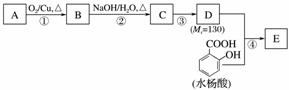
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为________;结构分析显示A只有一个甲基,A的名称为________。
(2)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为____________________________。
(3)C有________种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:________________________________________________________________________。
(4)第③步的反应类型为________;D所含官能团的名称为________。
(6)第④步的反应条件为________________;写出E的结构简式:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com