
(9分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
⑴NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+ 8NH3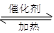 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
⑴3NO2+H2O=NO+2HNO3 (2分); 6.72 (2分)
⑵-41.8 (2分);b(1分);8/3 (2分);
【解析】(1)NO2溶于水生成NO和硝酸,反应的方程式是3NO2+H2O=NO+2HNO3;在反应6NO+ 8NH3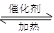 7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为
7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为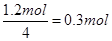 ,所以标准状况下的体积是
,所以标准状况下的体积是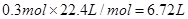 。
。
(2)本题考察盖斯定律的应用、化学平衡状态的判断以及平衡常数的计算。① 2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
②
2NO(g)+O2(g)
2SO3(g) ΔH1=-196.6 kJ·mol-1
②
2NO(g)+O2(g) 2NO2(g) ΔH2=-113.0 kJ·mol-1
。②-①即得出2NO2(g)+2SO2(g)
2NO2(g) ΔH2=-113.0 kJ·mol-1
。②-①即得出2NO2(g)+2SO2(g) 2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1=-113.0 kJ·mol-1 +196.6 kJ·mol-1=+83.6 kJ·mol-1。所以本题的正确答案是41.8;反应NO2(g)+SO2(g)
2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1=-113.0 kJ·mol-1 +196.6 kJ·mol-1=+83.6 kJ·mol-1。所以本题的正确答案是41.8;反应NO2(g)+SO2(g) SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。
SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。



科目:高中化学 来源: 题型:阅读理解
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| C(H2)C(CO) |
| C(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 .已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为
.已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省迁安市高二第一学期期中考试化学试卷(带解析) 题型:计算题
(9分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
⑴NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三10月月考化学试卷(解析版) 题型:填空题
(14分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+8NH3  7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
(2)已知:反应1:2SO2(g)+O2(g) 2SO3(g) ΔH = —196.6 kJ·mol-1
2SO3(g) ΔH = —196.6 kJ·mol-1
反应2:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
则反3:2NO(g)+O2(g) 2NO2(g)的 ΔH
= _________ kJ·mol-1
2NO2(g)的 ΔH
= _________ kJ·mol-1
(3) 一定条件下,将2molNO与2molO2置于恒容密闭容器中发生上述反应3,下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
|
物质 |
CO |
H2 |
CH3OH |
|
浓度(mol•L—1) |
0.9 |
1.0 |
0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com