
(18分)次氯酸钠(NaClO)和亚氯酸钠(NaClO3)都是重要的含氯消毒剂。
(1)NaClO2中,氯元素的化合价为________。
(2)某同学在实验室探究并制作一种家用环保型消毒液(NaClO)发生器,设计了如图的装置,用石墨作电极电解饱和氯化钠溶液。
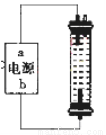
①通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源有b电极名称为_________(填“正”、“负”、“阴”或“阳”)投。
②装置中发生反应的有关化学方程式为________;充分电解后溶液中各离子浓度由大到小顺序为____。
③请说出使用该装置生产消毒液的一个优点和一个注意事项___________________。
(3)化学课外活动小组为测定某品牌“84消毒液”中NaClO的含量(单位体积溶液含有 NaCIO的质量),做了如下实验。已知:ClO-+2I-+2H+=Cl-+I2+H2O I2+2S2O32-=2I-+S4O62-
取10 mL该消毒液于锥形瓶中,迅速加入适量的硫酸酸化的碘化钾溶液,密封、充分混合,暗处放置几分钟。然后加入几滴淀粉溶液,用c mol/L的硫代硫酸钠(Na2S2O3) 标准溶液滴定,平均用去VmL硫代硫酸钠溶液。则该“84消毒液”中NaCIO的含量为_________g/mL(用含c、V的式子表示)。
(4)以下是过氧化氢法生产亚氯酸钠的工艺流程图:
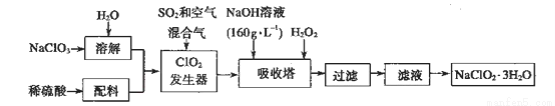
己知:(i)NaClO2 的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
(ii)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(iii) HClO2可看成是强酸。
①发生器中发生反应的离子方程式为__________,在发生器中鼓入空气的作用可能是_____。
②吸收塔内的反应的化学方程式为__________________。在吸收塔中为防止被还原成NaCI,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2
③从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是_________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(1)+3(1分) (2)①正(1分) ②2NaCl+2H2O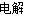 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
Cl2+2NaOH=NaCl+NaClO+H2O(2分) c(Na+)>c(ClO-)>c(OH-)>c(H+) (2分)
③方便、快捷(1分) 生成的可燃性气体,要及时处理,以免出现危险(1分)
(3) ×10-3cV(2分)(4)①2ClO
×10-3cV(2分)(4)①2ClO +SO2=2ClO2+SO
+SO2=2ClO2+SO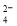 (2分) 稀释ClO2以防止爆炸(1分)
(2分) 稀释ClO2以防止爆炸(1分)
②2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑(2分) A(1分) ③BED(2分)
【解析】
试题分析:(1)根据化合物中元素化合价的代数和为0可知,氯酸钠中氯元素的化合价是2×2-1=+3价。
(2)①要使氯气完全被吸收,则下端产生氯气。电解时氯离子在阳极失去电子,所以b为电源的正极。
②电解氯化钠生成氯气、氢气和氢氧化钠,即2NaCl+2H2O 2NaOH+H2↑+Cl2↑。产生的氯气与氢氧化钠反应生成次氯酸钠,即Cl2+2NaOH===NaCl+NaClO+H2O。二者合并后的方程式为NaCl+H2O
2NaOH+H2↑+Cl2↑。产生的氯气与氢氧化钠反应生成次氯酸钠,即Cl2+2NaOH===NaCl+NaClO+H2O。二者合并后的方程式为NaCl+H2O 2NaClO+H2↑,次氯酸钠水解,溶液显碱性,则离子浓度大小顺序为c(Na+)>c(ClO-)>c(OH-)>c(H+)。
2NaClO+H2↑,次氯酸钠水解,溶液显碱性,则离子浓度大小顺序为c(Na+)>c(ClO-)>c(OH-)>c(H+)。
③根据装置可知,其优点是方便、快捷。但由于还同时产生氢气,氢气是可燃性气体,所以生成的可燃性气体,要及时处理,以免出现危险。
(3)根据方程式ClO-+2I-+2H+=Cl-+I2+H2O、I2+2S2O32-=2I-+S4O62-可知,ClO-~2S2O32-,所以次氯酸钠的物质的量是0.001cV/2mol,质量为0.0005cVmol×74.5g/mol=0.03725cVg,所以该“84消毒液”中NaCIO的含量为0.03725cVg÷10ml=0.003725cVg/ml。
(4)①由流程图可知C1O2发生器中目的是产生C1O2,二氧化硫具有还原性,将ClO3-还原为C1O2,自身被氧化为SO42-,反应离子方程式为2SO2+ClO3-=C1O2+2SO42-;由信息②可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸B;
②在双氧水的作用下氢氧化钠吸收ClO2生成亚氯酸钠、水和氧气,反应的方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑。
③还原性要适中,还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产。Na2O2溶于水相当于H2O2,Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难;故选A;
④从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体,故答案为BED。
考点:考查物质制备实验方案设计与评价


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.电解精炼铜时,粗铜与外接电源的负极相连
B.2Na2O2 + 2CO2 = 2Na2CO3 + O2在常温下能自发进行,则该反应的△H>0
C.由PbO2 +4HCl(浓)= PbCl2 + Cl2↑+2H2O 可确定氧化性:PbO2>Cl2
D.常温下,用蒸馏水不断稀释醋酸,溶液中c(CH3COO-)/c(CH3COOH)的值不变
查看答案和解析>>
科目:高中化学 来源:2015届河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为1.12 L(标况下)
查看答案和解析>>
科目:高中化学 来源:2015届河南省名校高三上学期期中考试理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式表示正确的是
A.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-===3I2+2NO↑+4H2O
B.硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=== BaSO4↓+H2O
C.FeCl3溶液中通入过量的H2S气体:2Fe3++H2S = S↓+2Fe2++2H+
D.NaHCO3溶液与过量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32—+2H2O
查看答案和解析>>
科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
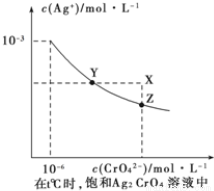
A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
查看答案和解析>>
科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
下列有关离子方程式书写正确的
A.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+4H++H2O
B.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
C.以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+4H++O2↑
D.过氧化氢能使酸性KMnO4溶液褪色:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:选择题
下列各组离子可能大量共存的是
A.不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2-
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C.pH= 12的溶液中:Na+、Ba2+、NO3-、Cl-
D.无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期目的。下列判断错误的是
A.废水处理时铝单质转化为Al3+ B.废水处理中,亚硝酸盐被还原
C.处理过程中,OH一参与了反应 D.铝粉颗粒大小影响废水处理的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com