
【题目】回答下列问题:
(1)已知两种同素异形体A、B的热化学方程式为:A(s)+O2(g)═CO2(g)△H=﹣393.51 kJ·mol-1;B(s)+O2(g)═CO2(g)△H=﹣395.41 kJ·mol-1则两种同素异形体中较稳定的是(填“A”或“B”)______。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示。
2NH3的能量变化如图所示。
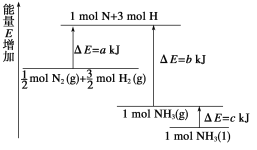
①1 mol N和3 mol H生成1 mol NH3(g)是_______能量的过程(填“吸收”或“释放”)。由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
②![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
(3)工业上用H2和Cl2反应制HCl,各键能为:H﹣H:436 kJ·mol-1,Cl﹣Cl:243 kJ·mol-1,H﹣Cl:431 kJ·mol-1。该反应的热化学方程式是_______________。
【答案】A 释放 释放 b-a △H = -(b+c-a)kJ·mol-1 H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ·mol-1
【解析】
(1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②分析反应的热效应,能量越高越不稳定;
(2)①原子结合为分子过程会放热;由图象可知,反应物的总能量大于生成物的总能量,反应放热;△H=生成物的活化能-反应物的活化能;
②根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态;
(3)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值。
(1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②得:A(s)=B(s)△H>0,所以B的能量高,能量越高越不稳定,A稳定;
(2)①原子结合为分子过程会放热,所以1mol N和3mol H生成1mol NH3(g)是释放能量的过程;由图象可知,反应物的总能量大于生成物的总能量,则该反应为放热反应,则![]() molN2(g)和
molN2(g)和![]() molH2(g)生成1mol NH3(g)过程时放热过程;△H=生成物的活化能-反应物的活化能=b-akJ/mol,所以1mol NH3(g)过程时放热b-akJ;
molH2(g)生成1mol NH3(g)过程时放热过程;△H=生成物的活化能-反应物的活化能=b-akJ/mol,所以1mol NH3(g)过程时放热b-akJ;
②![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)反应生成1 mol NH3(l)的△H =(akJmol-1)-(b kJmol-1+c kJmol-1)= -(b+c-a)kJmol-1;
mol H2(g)反应生成1 mol NH3(l)的△H =(akJmol-1)-(b kJmol-1+c kJmol-1)= -(b+c-a)kJmol-1;
(3)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:864kJ-679kJ=185kJ,所以△H=-183KJ/mol,所以反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】2017年中国科学家合成了一种高能量密度材料,该成果发表在《Nature》上,合成该材料所需主要原料为草酰二肼(结构如图)。下列有关草酰二肼的说法不正确的是

A. 具有碱性
B. 完全水解可得3种化合物
C. 含有的官能团也存在于蛋白质分子中
D. 与联二脲( )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。
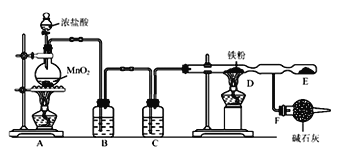
(1)写出A中反应的化学方程式:_______________________________________。
(2)装置B、C中应盛放的试剂名称分别为_____________、_____________;
(3)实验时,先点燃______________处的酒精灯, F装置所起的作用是:__________(答两点)。
(4)用石灰乳吸收氯气可制得漂白粉,写出工业制漂白粉的化学方程式: ______________,长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2g CH3OH(l)完全燃烧生成液态水和CO2,放出72.576 kJ的热量。下列热化学方程式正确的是
A.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH = - 72.576 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH = - 72.576 kJ·mol-1
B.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(g) ΔH = - 72.576 kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH = - 72.576 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH = - 1451.52 kJ·mol-1
D.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH = + 725.76 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH = + 725.76 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
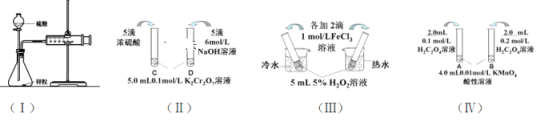
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。①此方法需要控制的变量有(至少写出两项):___。②为了衡量反应的快慢,还可以采用新的测定方法是_____。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
(3)实验(Ⅲ)①实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)①实验目的是_____。②溶液褪色的时间:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种紫黑色固体,只能在碱性环境中稳定存在,在中性或酸性中易分解,工业中通常是先制得高铁酸钠再转化为高铁酸钾。
I.制备NaCIO溶液
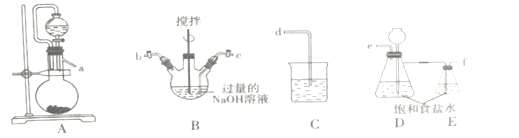
(1)装置的连接顺序为a→___→d。
(2)装置D的作用___。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,写出生成NaClO3的离子方程式___。
II.制备K2FeO4
(1)湿法制备K2FeO4:将Fe(NO3)3溶液滴加到装置B的混合溶液中,其反应的离子方程式是___。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是___(用简要的文字说明)。
(2)电解法制备K2FeO4(如图):

该装置中离子交换膜为___离子交换膜(填“阴”或“阳"),阳极电极反应式为___。
III.K2FeO4性质的探究
取电解后的溶液滴加稀盐酸,收集到黄绿色气体。针对以上现象,甲乙两位同学提出了以下猜想:
甲:气体只含有Cl2。
乙:气体除Cl2外还含有___,请设计实验证明乙同学的猜测___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下合成氨反应:N2+3H2![]() 2NH3 (每生成2 mol NH3放出92.4kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1molN2和3mol H2,达平衡时放出热量为Q1,②通入2 molN2和6 molH2,达平衡时放出热量为Q2,则下列关系正确的是
2NH3 (每生成2 mol NH3放出92.4kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1molN2和3mol H2,达平衡时放出热量为Q1,②通入2 molN2和6 molH2,达平衡时放出热量为Q2,则下列关系正确的是
A. Q2=2Q1=184.8kJB. Q1<0.5Q2
C. Q1<Q2<184.8kJD. Q1 =Q2 <92.4kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡___移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___pH(乙)(填“大于”、“小于”或“等于)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___V(乙)(填“大于”、“小于”或“等于”)。
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)____c(CH3COO-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
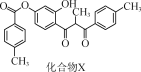
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com