
| A. | X、Y、W元素的原子半径依次递增 | |
| B. | X、Z、W元素的最高价氧化物的水化物的酸性依次递增 | |
| C. | X、W分别与Y形成化合物在常温下均为气态 | |
| D. | Z、W分别与Y形成的化合物均可作为耐高温材料 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,Y原子最外层电子数是电子层数的3倍,电子层数为2,最外层电子数为6,则Y为O元素;Y与W核外电子数相差6,则W为Si;W与X同主族,则X为C元素;Z的最外层电子数等于电子层数,结合原子序数可知Z处于第三周期,故Z为Al,据此解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,Y原子最外层电子数是电子层数的3倍,电子层数为2,最外层电子数为6,则Y为O元素;Y与W核外电子数相差6,则W为Si;W与X同主族,则X为C元素;Z的最外层电子数等于电子层数,结合原子序数可知Z处于第三周期,故Z为Al.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Y(O)<X(C)<W(Si),故A错误;
B.非金属性C>Si>Al,故最高价氧化物的水化物的酸性:偏铝酸<硅酸<碳酸,故B错误;
C.C、Si分别与O形成化合物中CO、二氧化碳为在常温下均为气态,而二氧化硅为固体,故C错误;
D.Al、Si分别与O形成的化合物分别为氧化铝、二氧化硅,均可作为耐高温材料,故D正确,
故选:D.
点评 本题考查结构性质位置关系,难度不大,推断元素是解题关键,注意元素周期律的理解及元素化合物知识掌握.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:填空题
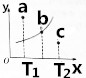 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:| 密闭容器 | A | B | C |
| n(起始状态)/mol | 4 | 2 | 0 |
| n(平衡状态)/mol | 2.8 | 1.4 | 1.2 |
| 密闭容器 | 甲 | 乙 | 丙 | 丁 | |
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| A的平衡转化率 | 80 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其原子最外电子层有7个电子的元素 | |
| B. | 最高正价为+3的元素 | |
| C. | 其原子最外层电子数大于电子层的元素 | |
| D. | 最高价氧化物对应的水化物是酸的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
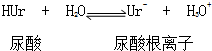 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)| A. | 反应的△H>0 | B. | 反应的△H=0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Cu作阴、阳电极,电解CuCl2溶液 | |
| B. | 用Cu作阴、阳电极,电解K2SO4溶液 | |
| C. | 铜锌合金在潮湿空气中发生电化学腐蚀 | |
| D. | Cu作原电池的负极,碳棒作正极,NaCl溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
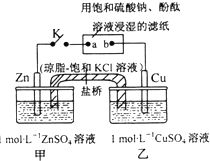
| A. | Zn极上发生还原反应 | |
| B. | 电子沿Zn→a→b→Cu路径流动 | |
| C. | 片刻后,乙池中c(Cu2+)减小,c(SO42-)基本不变,溶液不再保持电中性 | |
| D. | 片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
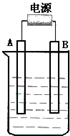 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
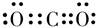
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com