
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
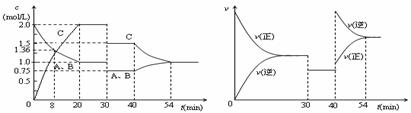
A.第8min时 A的反应速率为0.08mol·L-1·min-1
B.在0-54分钟的反应过程中该可逆反应的平衡常数始终为4
C.30min时改变的条件是降低温度,40min时改变的条件是升高温度
D.反应方程式中的x=1,且正反应为放热反应
科目:高中化学 来源: 题型:
将0.lmol· 醋酸溶液加水稀释,下列说法正确的是( )
醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(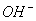 )都减小 B.溶液中c(H+)增大
)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H 2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/ mL | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
(1)已知:实验1、2、3的目的是探究KMnO4浓度对反应速率的影响。则实验2中m= ,
n= 。如果研究温度对化学反应速率的影响,需利用实验4和 。
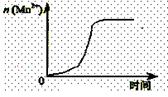 (2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
①请你填写表中空白帮助该小组同学完成实验方案。
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 |
| t3 |
②能说明该小组同学提出的假设成立的实验事实是 。
(3)有人将酸性KMnO4 溶液和H 2C2O4 溶液的反应设计成原电池,则该原电池的正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
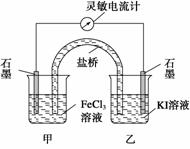
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
在固定容积的密闭容器中,可逆反应2X(?)+Y(g) Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
A.正反应为放热反应,X可能是气态、液态或固态 B.正反应为放热反应,X一定为气态
C.若X为非气态,则正反应为吸热反应 D.若加入少量的Z,该平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
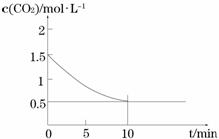 ⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时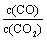 增大的是______(填序号)。
增大的是______(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示各物质之间的转化关系。已 知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元
知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元 素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
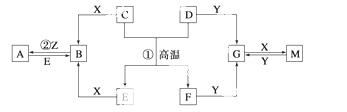
(1)写出下列物质的化学式:B___ _________、G___________________、Y______________。
_________、G___________________、Y______________。
(2)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则E是__________极,请写出在此电极上发生的电极反应式: ________________。
(3)写出反应①的化学方程式___________。
(4)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.097×10-39。将
0.01 mol·L-1的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀_______(填“能”或“不能”),请通过计算说明_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某些溶液中含有的杂质用一般方法难以除去,而用电解法则是一种很有效的方法。以下杂质(括号内为杂质)不能用惰性电极电解法除去的是( )
A. Na2SO4溶液(CuSO4) B. NaNO3溶液(CuCl2)
C. MgSO4溶液(CuCl2) D. NaNO3溶液(MgCl2)
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁“发蓝”是在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:① 3Fe+NaNO2+5NaOH→3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O→3Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O→Fe3O4+4NaOH;
下列说法正确的是 ( )
A.该生产过程不会产生污染 B.反应①②中的氧化剂均为NaNO2
C.反应①②③均是氧化还原反应 D.四氧化三铁具有抗腐蚀作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com