
| 起始浓度/mol?L-1 | 1.0 | 3.0 | 0.2 |
| 2s末浓度/mol?L-1 | 0.6 | 1.8 | 1.0 |
| 4s末浓度/mol?L-1 | 0.4 | 1.2 | 1.4 |
| A、2s末氨气的反应速率=0.4mol?(L?s)-1 |
| B、前2s时间内氨气的平均反应速率=0.4mol?(L?s)-1 |
| C、前4s时间内氨气的平均反应速率=0.3mol?(L?s)-1 |
| D、2~4s时间内氨气的平均反应速率=0.2mol?(L?s)-1 |
| △c |
| △t |
| 0.8mol/L |
| 2s |
| 1.2mol/L |
| 4s |
| 0.4mol/L |
| 4s-2s |


科目:高中化学 来源: 题型:
| A、除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| B、除去CO2中混有的HCl:用饱和NaHCO3溶液洗气 |
| C、除去BaCO3固体中混有的BaSO4:加入过量的盐酸、过滤、洗涤 |
| D、除去甲烷中混有的乙炔:通过溴水溶液后,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中只含Cl2和H2O分子 |
| B、光照氯水,有气体逸出,该气体为Cl2 |
| C、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| D、氯水密封放置数天后pH将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
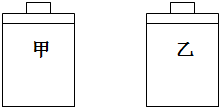
| A、(a)甲>乙,(b)甲>乙 |
| B、(a)甲>乙,(b)甲=乙 |
| C、(a)甲<乙,(b)甲>乙 |
| D、(a)甲>乙,(b)甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
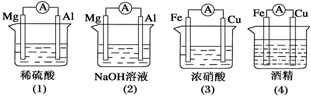
| A、(1)(2)中Mg作负极 |
| B、(3)中Fe作负极,电极反应为Fe-2e-═Fe2+ |
| C、(2)中Mg作正极,电极反应为6H2O+6e-═6OH-+3H2↑ |
| D、(4)中Fe作负极,电极反应为Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C三个电解槽,如下图所示(其中电极的大小、形状、间距均相同).B、C中溶液浓度和体积相同,通电一段时间后,当A中铜电极的质量增加0.128g时,B中电极上银的质量增加( )
A、B、C三个电解槽,如下图所示(其中电极的大小、形状、间距均相同).B、C中溶液浓度和体积相同,通电一段时间后,当A中铜电极的质量增加0.128g时,B中电极上银的质量增加( )| A、0.054g |
| B、0.108g |
| C、0.216 |
| D、0.432g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当△H为负值时,表示该反应为吸热反应 |
| B、燃烧不一定是放热反应 |
| C、反应热的大小与反应物所具有的能量和生成物具有的能量无关 |
| D、反应热的大小只与反应体系的始态和终态有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4 g金属镁所含电子数目为0.2 NA |
| B、16 g CH4所含原子数目为NA |
| C、17 g NH3 所含氢原子数目为4 NA |
| D、18 g水所含分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 分类 | 单质 | 盐 | 胶体 | 强电解质 |
| 物质 | 液溴、碘(I2)、钢 | 食盐、生石灰、小苏打 | 牛奶、淀粉溶液、氢氧化铁胶体 | 醋酸、纯碱、烧碱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com