
| A. | 若溶液中c(Cl-)=c(NH4+),则溶液一定呈中性 | |
| B. | 若c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶质一定为NH4Cl | |
| C. | 若c(OH-)>c(H+),则溶液中不可能存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若溶质为NH4Cl、NH3•H2O,则一定存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
分析 A.若溶液中c(Cl-)=c(NH4+),根据电荷守恒判断c(H+)、c(OH-)相对大小,从而确定溶液酸碱性;
B.若c(Cl-)>c(NH4+)>c(H+)>c(OH-),说明溶液呈酸性,溶液中溶质可能为氯化铵和HCl,但氯化铵浓度远远大于HCl浓度;
C.若c(OH-)>c(H+),溶液呈碱性,溶液中溶质为氯化铵和一水合氨;
D.若溶质为NH4Cl、NH3•H2O,如果溶液中氯化铵浓度大于一水合氨浓度,则存在c(OH-)<c(Cl-).
解答 解:A.若溶液中c(Cl-)=c(NH4+),根据电荷守恒得c(H+)=c(OH-),则溶液呈中性,故A正确;
B.若c(Cl-)>c(NH4+)>c(H+)>c(OH-),说明溶液呈酸性,溶液中溶质可能为氯化铵和HCl或只含氯化铵,如果含有氯化铵和稀盐酸则氯化铵浓度应该远远大于HCl浓度,故B错误;
C.若c(OH-)>c(H+),溶液呈碱性,溶液中溶质为氯化铵和一水合氨,如果氨水浓度远远大于氯化铵浓度,则溶液中可能存在c(NH4+)>c(OH-)>c(Cl-)>c(H+),故C错误;
D.若溶质为NH4Cl、NH3•H2O,如果溶液中氯化铵浓度大于一水合氨浓度,则存在c(OH-)<c(Cl-),如果一水合氨浓度大于氯化铵浓度,则可以存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,根据溶液中溶质相对大小确定溶液离子浓度大小,注意电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3Br2+6KOH═5KBr+KBrO3+3H2O | |
| B. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑ | |
| C. | 2KNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2KNO2+O2↑ | |
| D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$ N2O↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
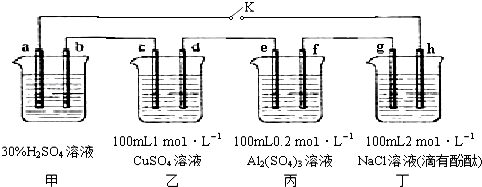
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H | B. | F | C. | Na | D. | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨与O2反应 | B. | 硫磺与O2反应 | ||
| C. | 闪电时,氮气与O2反应 | D. | 硅在足量的O2中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O与CuCl反应的化学方程式为Ag2O+2CuCl═2AgCl+Cu2O | |
| B. | Ag2O溶于稀硝酸的离子方程式为Ag2O+2H+═2Ag++H2O | |
| C. | CuCl可以用铜在氯气中燃烧来制备 | |
| D. | 可以用稀硝酸来鉴别Ag2O与CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com