
 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
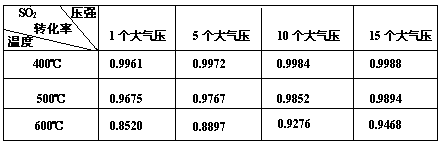
| ѹǿMPa ת����% �¶�/�� |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10�֣������ǹ�ҵ��������Ϊ��Ҫ�IJ�Ʒ֮һ���ڴ���Ӧ������еķ�ӦΪ��
2SO2(g)+O2(g)2SO3(g) ��H= �C196.6 kJ��mol-1
��1���÷�Ӧ����������ͨ����400~500�桢 �� ��
��2��SO3�� �����豸���ƣ����� �����Լ����ƣ����ա�
��3���о�SO2 ��NO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��֪�� 2NO(g)+O2(g)2NO2(g) ��H= �C113.0 kJ��mol-1
��ӦNO2(g)+SO2(g)SO3(g)+NO(g)�Ħ�H= kJ��mol-1��
һ�������£���NO2��SO2�����ʵ���֮��1:2���ں����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol SO3��ͬʱ����1 mol NO2
���������Ӧƽ��ʱNO2��SO2�����ʵ���֮��Ϊ1:6����ƽ�ⳣ��K�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ������������һ�и߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��10�֣������ǹ�ҵ��������Ϊ��Ҫ�IJ�Ʒ֮һ���ڴ���Ӧ������еķ�ӦΪ��
2SO2(g)+O2(g) 2SO3(g) ��H=" �C196.6" kJ��mol-1
2SO3(g) ��H=" �C196.6" kJ��mol-1
��1���÷�Ӧ����������ͨ����400~500�桢 �� ��
��2��SO3�� �����豸���ƣ����� �����Լ����ƣ����ա�
��3���о�SO2 ��NO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��֪�� 2NO(g)+O2(g) 2NO2(g) ��H=" �C113.0" kJ��mol-1
2NO2(g) ��H=" �C113.0" kJ��mol-1
��ӦNO2(g)+SO2(g) SO3(g)+NO(g)�Ħ�H= kJ��mol-1��
SO3(g)+NO(g)�Ħ�H= kJ��mol-1��
һ�������£���NO2��SO2�����ʵ���֮��1:2���ں����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol SO3��ͬʱ����1 mol NO2
���������Ӧƽ��ʱNO2��SO2�����ʵ���֮��Ϊ1:6����ƽ�ⳣ��K�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ɽ��ʡ������ѧ�߿�����ģ�����⣨���������ۺϻ�ѧ�Ծ����������� ���ͣ�ʵ����
[��ѧ����ѡ��ѧ�뼼��]��15�֣�
�����ǹ�ҵ��������Ϊ��Ҫ�IJ�Ʒ֮һ��
��1����ҵ����������Ҫ��Ϊ_________��________��_________�����Ρ�
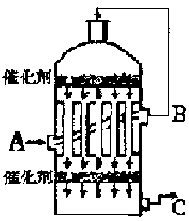
��2�������ǵڶ��η�Ӧ���й�ʵ�����ݣ���ѡ������ʵ���������____________��
��3����������߷�Ӧ���ʺ�SO2��ת���ʣ����д�ʩ���е��ǣ� ��
| A����װ����ͨ�뵪���ұ���������� |
| B����װ����ͨ�������ұ���������� |
| C�����Ӹ���Ĵ��� |
| D�������¶ȣ���ʱת��SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�������и߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��10�֣������ǹ�ҵ��������Ϊ��Ҫ�IJ�Ʒ֮һ���ڴ���Ӧ������еķ�ӦΪ��
2SO2(g)+O2(g) 2SO3(g) ��H= �C196.6 kJ��mol-1
2SO3(g) ��H= �C196.6 kJ��mol-1
��1���÷�Ӧ����������ͨ����400~500�桢 �� ��
��2��SO3�� �����豸���ƣ����� �����Լ����ƣ����ա�
��3���о�SO2 ��NO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��֪�� 2NO(g)+O2(g) 2NO2(g)
��H= �C113.0 kJ��mol-1
2NO2(g)
��H= �C113.0 kJ��mol-1
��ӦNO2(g)+SO2(g) SO3(g)+NO(g)�Ħ�H=
kJ��mol-1��
SO3(g)+NO(g)�Ħ�H=
kJ��mol-1��
һ�������£���NO2��SO2�����ʵ���֮��1:2���ں����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol SO3��ͬʱ����1 mol NO2
���������Ӧƽ��ʱNO2��SO2�����ʵ���֮��Ϊ1:6����ƽ�ⳣ��K�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com