【答案】
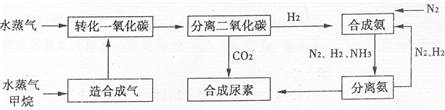
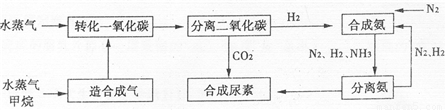
分析:(1)在高温高压条件下,NH
3与CO
2反应生成NH
2COONH
4,NH
2COONH
4加热分解生成CO(NH
2)
2与H
2O.
(2)A.催化剂不影响平衡移动.
B.由工艺流程可知,进入分离二氧化碳装置的气体有H
2O、CH
4、H
2、CO
2等.
C.N
2、H
2的循环使用,提高了原子的利用率.
D.由游离态的氮元素转化为化合态,称为固氮.
E.天然气是化石能源,属于不可再生资源,.
(3)500℃的温度反应速率较快,催化剂活性最高.
(4)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值.
降低温度,平衡常数K减小,平衡向逆反应进行,降低温度平衡向放热反应方向移动.
根据关系式CH
4~CO~3H
2计算造合成气的反应中生成的CO、H
2的体积,根据关系式 CO~H
2计算分离二氧化碳过程生成的H
2体积,两部分氢气体积为生成氢气的总体积,再根据 3H
2~2NH
3计算生成氨气的体积.
解答:解:(1)在高温高压条件下,NH
3与CO
2反应生成NH
2COONH
4,NH
2COONH
4加热分解生成CO(NH
2)
2与H
2O.
反应方程式为①2NH
3+CO
2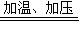
NH
2COONH
4,②NH
2COONH
4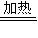
CO(NH
2)
2+H
2O.
故答案为:①2NH
3+CO
2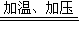
NH
2COONH
4,②NH
2COONH
4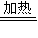
CO(NH
2)
2+H
2O.
(2)A.使用催化剂加快反应速率,缩短到达平衡时间,催化剂不影响平衡移动,CO的转化率不变,故A错误;
B.由工艺流程可知,进入分离二氧化碳装置的气体有H
2O、CH
4、H
2、CO
2等,故B错误;
C.N
2、H
2的循环使用,充分利用氮元素、氢元素,提高了原子的利用率,故C正确;
D.氨中的氮元素属于化合态,二氧化碳与氨合成尿素,不是游离态的氮元素转化为化合态,不属于人工固氮,故D错误;
E.天然气是化石能源,属于不可再生资源,故E错误.
故选:C.
(3)合成氨反应是放热反应,虽然温度越高对反应有抑制作用,但是在500度时催化剂的活性最大,反应速率也很快.综合考虑工业生产选择500度的高温.
故答案为:500℃的温度反应速率较快,催化剂活性最高.
(4)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值.所以反应CH
4(g)+H
2O(g)?CO(g)+3H
2(g)的平衡常数k=
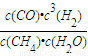
.
降低温度,平衡常数K减小,平衡向逆反应进行,降低温度平衡向放热反应方向移动,故该反应正反应为吸热反应.
根据关系式计算造合成气的反应中生成的CO、H
2的体积:
合成气的反应中:CH
4~~~~~~~~~CO~~~~~~~~~~3H
2,
5.60xlO
7L×0.75 5.60xlO
7L×0.75 5.60xlO
7L×0.75×3
分离二氧化碳过程生成的H
2体积:CO~~~~~~~~~~H
2,
5.60xlO
7L×0.75 5.60xlO
7L×0.75
所以产生的氢气的总体积为5.60xlO
7L×0.75×3+5.60xlO
7L×0.75=5.60xlO
7L×0.75×4
令产生氨气的体积为V,则:
3H
2~~~~~~~~~2NH
3 3 2
5.60xlO
7L×0.75×4×40% V
解得,V=5.60xlO
7L×0.75×4×40%×

=4.48xlO
7L
故答案为:
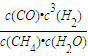
;吸;4.48xlO
7L.
点评:考查学生对工艺流程的理解、化学平衡移动及平衡常数与计算、合成氨条件的选择等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.(4)中计算为易错点,容易忽略分离二氧化碳过程生成的H
2体积.

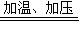 NH2COONH4,②NH2COONH4
NH2COONH4,②NH2COONH4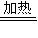 CO(NH2)2+H2O.
CO(NH2)2+H2O.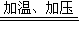 NH2COONH4,②NH2COONH4
NH2COONH4,②NH2COONH4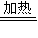 CO(NH2)2+H2O.
CO(NH2)2+H2O.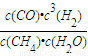 .
. =4.48xlO7L
=4.48xlO7L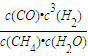 ;吸;4.48xlO7L.
;吸;4.48xlO7L.