
【题目】NA代表阿伏加德罗常数的值。下列叙述错误的是
A.100g 9.8%的硫酸与磷酸的混合溶液中含氧原子数为0.4NA
B.向100mL0.1 mol/L 醋酸溶液中加入CH3COONa固体至溶液刚好为中性,溶液中醋酸分子数为0.01NA
C.等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等
D.含2.8g硅的SiO2晶体中存在的共价键总数为0.4NA
【答案】A
【解析】
A.100g 9.8%的硫酸与磷酸的混合溶液中含有硫酸和磷酸的总质量为9.8g,物质的量总和为0.1mol,酸中含有氧原子数为0.4NA,但水中也有氧原子,则总的氧原子数大于0.4NA,A项错误;
B.向100mL0.1 mol/L 醋酸溶液中加入CH3COONa固体至溶液刚好为中性,则溶液中氢离子浓度和氢氧根离子浓度相等,醋酸分子的电离程度与醋酸根离子的水解程度相当,则可认为醋酸不电离,醋酸根离子不水解,因此醋酸分子数为![]() ,B项正确;
,B项正确;
C.甲基和羟基均含有9个电子,则等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等,C项正确;
D.2.8g硅的物质的量为0.1mol,所对应的SiO2为0.1mol,SiO2晶体中每个硅原子形成4个Si-O共价键,故0.1molSiO2晶体中存在的共价键总数为0.4NA,D项正确;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 核磁共振氢谱、红外光谱都能够快速精确地测定有机物的相对分子质量
B. 异戊烷和新戊烷可以用质谱法快速的区分
C. 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体
D. ![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明甲酸![]() 属于弱酸的是( )
属于弱酸的是( )
①1mol/LHCOOH的pH=2 ②甲酸能与水以任意比互溶
③20mL 1mol/LHCOOH与20mL 1mol/LNaOH恰好中和 ④HCOONa溶液的pH>7
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种含酰亚胺结构的对苯二胺衍生物的合成路线,其产物(F)可作为一种空腔孔径较大的新型大环芳酰胺的合成原料。
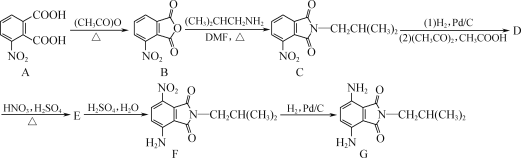
(1)A中官能团的名称为________和________。
(2)F→G的反应类型为________。
(3)D的分子式为C14H16N2O3,写出D的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②含有苯环,且苯环上含有硝基;
③含有三种不同化学环境的氢原子。
(5)写出以甲苯、邻二甲苯,制备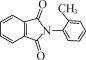 (无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
(无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
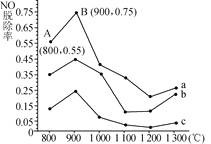
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化示意图如图:

Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。

(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:

研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。
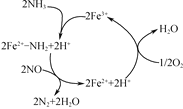
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-=CaCO3↓+ H2O
C.向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)基态Ni原子核外的最高能层符号是______,基态Ni2+最外层电子排布式为_______,未成对电子数为________________。
(2)[Co(NO![]() )4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
)4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
(3)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如图所示:
①上述三种晶体的晶胞中属于体心立方晶胞的是______(填“α”“δ”或“γ”)-Fe。
②γ-Fe晶胞中铁原子的配位数为_______________。
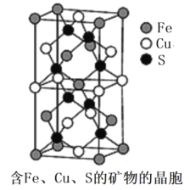
(4)一种含有Fe、Cu、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为Apm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________g/cm3(写出表达式)。
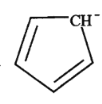
(5)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249℃,易升华,难溶于水,易溶于有机溶剂,它属于__________晶体。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H![]() )结构如图所示,其中的大π键可以表示为_______。
)结构如图所示,其中的大π键可以表示为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容容器中,用CO2和H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
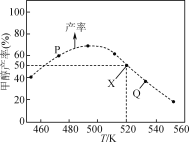
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH>0
CH3OH(g)+H2O(g)的ΔH>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2的转化率
D.520K时,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=
CH3OH(g)+H2O(g)的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氰氨基化钙的化学方程式为CaCO3+2HCN![]() CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
A. 氢元素被氧化, 碳元素被还原
B. HCN被氧化, CaCO3被还原
C. HCN是氧化剂, CaCO3是还原剂
D. CaCN2是氧化产物, H2为还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com