
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下合成甲醇,发生的反应为CO(g)+2H2(g)![]() CH3OH(l) ΔH=?
CH3OH(l) ΔH=?
(1)已知CO、H2、CH3OH的燃烧热分别为283.0kJ·mol-1、285.8kJ·mol-1、726.5kJ·mol-1,则ΔH=__。
(2)在一容积为2L的恒容密闭容器中加入0.2molCO和0.4molH2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。
时间 温度/℃ | 10min | 20min | 30min | 40min | 50min | 60min |
T1 | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
T2 | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
①由上述数据可以判断:T1__T2(填“>”“<”或“=”)。
②T1℃时,0~20minH2的平均反应速率v(H2)=__。
③该反应在T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是__(填字母)。
A.改用高效催化剂
B.升高温度
C.缩小容器容积
D.分离出甲醇
E.增加CO的浓度
(3)若保持T2℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应满足的条件:__。
(4)当反应在T1℃进行20min时,迅速将0.02molCO、0.04molH2、0.18molCH3OH同时投入体系中,同时将反应体积扩大为原来的2倍,反应在40min时达到平衡,请在图中画出20~40min内容器中H2浓度的变化趋势曲线___。
(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为__(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
【答案】-128.1kJ·mol-1 < 0.006mol·L-1·min-1 CE a+c=0.2,b+2c=0.4 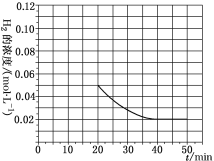 CH3OH-6e-+H2O=CO2↑+6H+ 80%
CH3OH-6e-+H2O=CO2↑+6H+ 80%
【解析】
(1)根据已知的燃烧热书写热化学方程式,推导所求反应,再根据盖斯定律计算所求反应的焓变;
(2)①反应为放热反应,温度升高不利于反应正向进行;
②根据表中数据计算CH3OH的生成速率,再由化学反应速率之比等于化学计量数之比计算H2的消耗速率;
③该反应T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,从浓度,压强,温度角度逐项分析;
(3)与原平衡等效,即将反应物一边倒时,与原反应物一致;
(4)由“一边倒”计算可知通入0.02 mol CO、0.04 mol H2、0.18 mol CH3OH与通入0.2 mol CO、0.4 mol H2完全等效,即达新平衡时H2的浓度与原平衡相同,计算出图象的起点和平衡点的量,再作图;
(5)原电池负极发生氧化反应,电解质溶液为酸性,CH3OH转化为CO2和H+,据此写出负极的电极反应,根据反应的热量变化计算。
(1)CO、H2、CH3OH的燃烧热分别为283.0kJ·mol-1、285.8kJ·mol-1、726.5kJ·mol-1,则①CO(g)+![]() O2(g)=CO2(g)△H1=-283.0kJ/mol,②H2(g)+
O2(g)=CO2(g)△H1=-283.0kJ/mol,②H2(g)+![]() O2(g)=H2O(l)△H2=-285.8kJ/mol,③CH3OH(l)+
O2(g)=H2O(l)△H2=-285.8kJ/mol,③CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H3=-726.5kJ/mol,CO(g)+2H2(g)CH3OH(l)可由①+2×②-③得到,根据盖斯定律,该反应的焓变为△H=△H1+2△H2-△H3=-128.1kJ/mol,故答案为:-128.1kJ/mol;
O2(g)=CO2(g)+2H2O(l)△H3=-726.5kJ/mol,CO(g)+2H2(g)CH3OH(l)可由①+2×②-③得到,根据盖斯定律,该反应的焓变为△H=△H1+2△H2-△H3=-128.1kJ/mol,故答案为:-128.1kJ/mol;
(2)①CO(g)+2H2(g)CH3OH(l) △H=-128.1kJ/mol,为放热反应,温度升高,平衡逆向移动,平衡时甲醇含量降低,所以温度T1℃<T2℃,故答案为:<;
②T1℃时,0~20min内,CH3OH的生成速率为v(CH3OH)=![]() =0.003mol/(Lmin),由化学反应速率之比等于化学计量数之比,则H2的消耗速率为v(H2)=2v(CH3OH)=0.006mol/(Lmin),故答案为:0.006mol/(Lmin);
=0.003mol/(Lmin),由化学反应速率之比等于化学计量数之比,则H2的消耗速率为v(H2)=2v(CH3OH)=0.006mol/(Lmin),故答案为:0.006mol/(Lmin);
③A.改用高效催化剂,催化剂只能改变化学反应速率,但不改变化学平衡,故A不选;B.升高温度,有利于加快化学反应速率,但不利于反应正向进行,不利于提高CH3OH产量,故B不选;C.缩小容器体积,相当于加压,有利于加快化学反应速率,有利于反应正向进行,即有利于提高CH3OH产量,故C选;D.分离出甲醇,减小逆反应速率,瞬时不改变正反应速率,有利于反应正向进行,故D
(3)T1温度下,平衡时n(CH3OH)=0.18mol,则n(CO)=0.02mol,n(H2)=0.04mol,保持T1℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,将反应物一边倒,等效为起始时n(CO)=a+c,n(H2)=b+2c,则a+c=0.2,b+2c=0.4,故答案为:a+c=0.2,b+2c=0.4;
(4)当反应在T1℃进行20min时,迅速将0.02molCO、0.04molH2、0.18molCH3OH同时投入体系中,同时将反应体积扩大为原来的2倍,由“一边倒”计算可知通入0.02 mol CO、0.04 mol H2、0.18 mol CH3OH与通入0.2 mol CO、0.4 mol H2完全等效,即达新平衡时H2的浓度与原平衡相同,继续充入0.4 mol H2的瞬间H2的浓度变为![]() =0.05 mol·L-1,平衡时c(H2)=
=0.05 mol·L-1,平衡时c(H2)=![]() =0.02 mol·L-1,变化趋势图为:
=0.02 mol·L-1,变化趋势图为: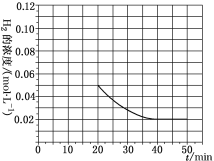 ,故答案为:
,故答案为: ;
;
(5)原电池负极发生的是燃料(CH3OH)失去电子的氧化反应,电解质溶液为酸性,CH3OH转化为CO2和H+,则负极的电极反应为:CH3OH-6e-+H2O=CO2↑+6H+,理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,2mol甲醇完全燃烧释放的热量为2×726.5kJ=1453kJ,所以该燃料电池的理论效率为![]() ×100%=80%,故答案为:CH3OH-6e-+H2O=CO2↑+6H+;80%。
×100%=80%,故答案为:CH3OH-6e-+H2O=CO2↑+6H+;80%。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】2020年2月,国家卫生健康委办公厅、国家中医药管理局办公室联合发出《关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知》。此次诊疗方案抗病毒治疗中增加了阿比多尔这个药物。其中间体I的合成路线如下:

(1)A的结构简式是 _____。
(2)I中含氧官能团名称是_____。
(3)③、⑦的反应类型分别是 _____________、 __________ 。
(4)②的化学方程式为_________________________。
(5)D的同分异构体中,满足下列条件的有_______种。
a. 含有苯环 b.含有-NO2
其中核磁共振氢谱为3组峰,且峰面积之比为1∶2∶6的为____________(任写一种结构简式)。
(6)已知:①当苯环有RCOO-、烃基时,新导入的基团进入原有基团的邻位或对位;原有基团为-COOH时,新导入的基团进入原有基团的间位。②苯酚、苯胺(![]() )易氧化。设计以
)易氧化。设计以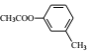 为原料制备
为原料制备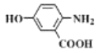 的合成路线(无机试剂任用)__________________。
的合成路线(无机试剂任用)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面内,H的分子式是C7H8。
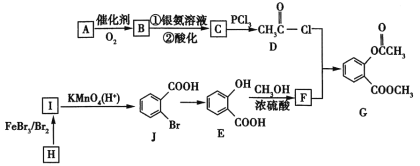
已知:![]() 。
。
回答下列问题。
(1)A的结构简式是___________。
(2)H→I的化学方程式为__________,B与银氨溶液反应的化学方程式是__________。
(3)C→D的反应类型是______,I→J的反应类型是______。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_______________。
(5)满足以下条件的F的同分异构体(不含F)共有_________种。
①能与氯化铁溶液发生显色反应 ②分子中有—COO—结构 ③苯环上有两个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是_________________________(填编号)。
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__________。
(3)做酸碱中和滴定时,还缺乏的试剂是____________________。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的______(填编号)。甲.酸式滴定管 乙.碱式滴定管 丙.锥形瓶
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是______________。
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH2______0,ΔS______0 (填“>”、“=”或“<”=)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________。
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式____________________。
②写出上图电池装置中负极反应式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
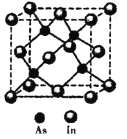
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酚为原料制备胡椒乙酸的合成路线如图所示。

回答下列问题:
(1)下列关于有机物B的说法正确的是 ____________(填字母)。
a.能与FeCl3溶液发生显色反应
b.核磁共振氢谱中只有3组峰
c.能发生银镜反应
d.能与溴水发生加成反应
(2)C的名称是___________,C D的反应类型是_______。
(3)胡椒乙酸(E)中所含官能团的名称为 __________ 。
(4)G生成F的化学方程式为_____________。
(5)W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成1 mol C02,已知W的苯环上只有2个取代基,则W的结构共有__________(不含立体异构)种,其中核磁共振氢谱有五组峰的结构简式为_______。
(6)参照上述合成路线,写出以一氯甲苯(![]() )为原料(无机试剂任选)制备苯乙酸的合成路线:____________________
)为原料(无机试剂任选)制备苯乙酸的合成路线:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
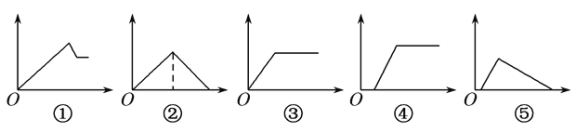
溶液 | 加入物质 | 相应序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和澄清石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合溶液 | 逐滴加入NaOH溶液至过量 |
A. ①③②④⑤ B. ③⑤④②①
C. ①②③④⑤ D. ③②④⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O工艺流程如下
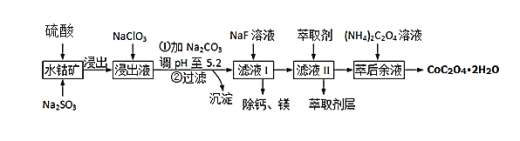
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
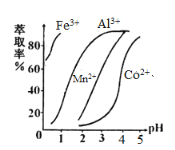
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O42H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二次电池锂离子电池广泛应用于手机和电脑等电子产品中。某常见锂离子电池放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。2018年中国回收了全球可回收锂离子电池总量的69%。但现阶段我国废旧电池回收仍属于劳动密集型产业,效率仍需提高。一种回收该锂离子电池中的锂和钴的流程:
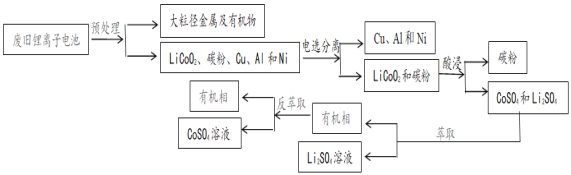
已知:① Na2S2O3是一种中等强度的还原剂,遇强酸分解
② Li2CO3溶解度随温度升高而减小
(1)关于该锂离子电池说法不正确的是_______________________________
A.锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,应先进行放电处理
C.充电时若转移0.01mol电子,石墨电极将减重0.07g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,且Co3+在常温、pH=0.5条件下即开始水解。LiCoO2可溶于硫酸得CoSO4。用硫酸酸浸时,需要加入Na2S2O3作助溶剂,从化学反应原理的角度解释原因:_______________________________,写出浸出CoSO4的离子反应方程式:__________________
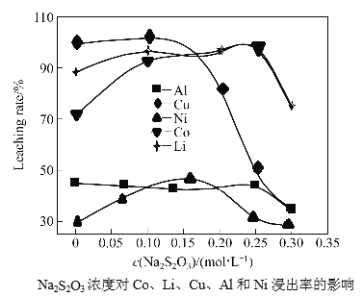
(3)控制氢离子浓度为4mol/L,反应温度90℃,测得相同时间内离子的浸出率与Na2S2O3溶液的变化关系如图。则酸浸时应选用浓度为_______mol/L的Na2S2O3溶液。Na2S2O3溶液浓度增至0.3mol/L时,LiCoO2的浸出率明显下降,可能的原因是_________________(用化学方程式结合文字说明)
(4)整个回收工艺中,可循环使用的物质是_____________________
(5)已知15℃左右Li2CO3的Ksp为3.210-2,该温度下Li2CO3的溶解度约为_____g。将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,________________(填操作)得Li2CO3粉末。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com