
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
分析 雨形成的主要原因是大量燃烧化石燃料,产生二氧化硫,随雨降落形成,酸雨放置时,发生的反应为:2H2SO3+O2=2H2SO4,由弱酸生成强酸,酸性增强.
解答 解:酸雨形成的主要原因是:大量燃烧化石燃料(煤和石油等),产生二氧化硫,随雨降落形成,酸雨样品放置,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,
故答案为:酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强.
点评 本题考查二氧化硫的污染及治理,侧重于基础知识的考查,题目难度不大,注意把握二氧化硫的性质,为解答该题的关键,该题有利于培养学生的良好的科学素养,提高学生学习的积极性.


科目:高中化学 来源: 题型:选择题

| A. | 甲池通入O2的电极反应为O2+4e-+4H+=2H2O | |
| B. | 乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子 | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
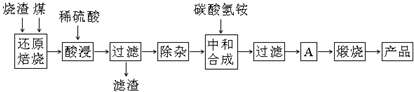
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
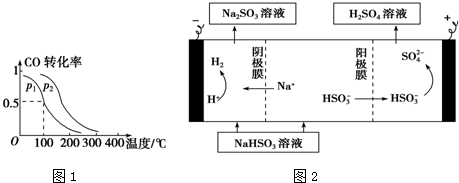
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③⑤⑦ | C. | ②⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子数为3 | B. | 相对原子质量为2 | ||
| C. | 原子的核电荷数为3 | D. | 原子结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
.C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 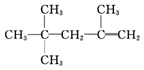 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 | |
| B. | 化合物 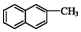 不是苯的同系物 不是苯的同系物 | |
| C. | 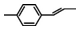 分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com