
| 选项 | 物质(杂质) | 试剂 | 方法 |
| A | CO2(SO2) | 饱和Na2CO3溶液 | 洗气 |
| B | NaCl溶液(Na2CO3) | BaCl2 | 过滤 |
| C | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| D | KI溶液(I2) | 乙醇 | 萃取分液 |
| A. | A | B. | B | C. | C | D. | D |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4 L Cl2含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
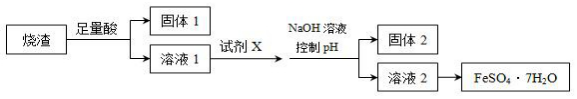
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH为使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| D. | 聚氯乙烯塑料薄膜可用作食品保鲜膜、一次性食品袋等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | NH4++H2O?NH4OH+H+ | ||
| C. | HCO3-+H2O?CO2↑+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁与0.05mol Cl2充分反应,转移0.1NA电子 | |
| B. | 27g Al与足量NaOH溶液反应生成 33.6L H2 | |
| C. | 1mol由乙烯(C2H4)和乙烷(C2H6)组成的混合物中含有碳原子的数目为2NA | |
| D. | 0.1mol Na2O2与足量二氧化碳反应转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
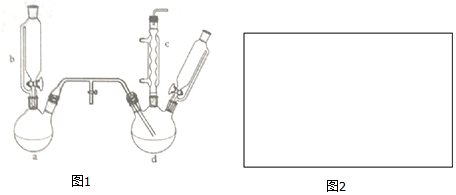
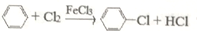 .
.| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量(t/kg) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com