
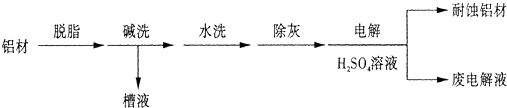
对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法

①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c. NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为 。电解后的铝材需氨洗的目的是 。阳极氧化膜中有微孔,需进行封孔,封孔的操作方法是 。
2.镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
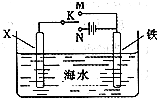
3.利用下图装置,可以模拟铁的电化学防护。
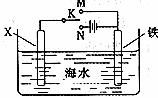
若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
(1)①2Al+2OH-+2H2O=2AlO2+3H2↑;(2分) b (1分)
②2Al+3H2O-6e-=Al2O3+6 H+(2分);中和表面的酸溶液。(1分)将铝材放在沸水中浸煮5分钟。(1分)
(2)补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定。(1分)
(3)N(1分);牺牲阳极的阴极保护法(或:牺牲阳极保护法)(1分)
【解析】(1)①铝能和氢氧化钠溶液反应生成氢气,当其表面的氧化膜洗去后,铝就和氢氧化钠溶液反应生成氢气,方程式是2Al+2OH-+2H2O=2AlO2+3H2↑;碱洗的溶液中铝以AlO2-的形成存在。由于氢氧化铝是两性氢氧化物,所以应该通入CO2,而不能加入硝酸,答案选b。
②电解池中阳极失去电子,因此阳极是铝失去电子,生成氧化铝,方程式是2Al+3H2O-6e-=Al2O3+6 H+。由于反应中生成氢离子,所以氨洗的目的是中和表面的酸溶液。微空存在石墨含有气体,因此封空的方法是将铝材放在沸水中浸煮5分钟。
(2)镀铜时溶液中镀铜离子在阴极得到电子而析出,所以铜做阳极的目的是补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定,所以不能用石墨做阳极。
(3)①铁是活泼的金属,而碳棒是惰性电极,所以应该用外接电源的阴极保护法,即K应该置于N处。
②锌的活泼性强于铁的,所以K置于M处是牺牲阳极的阴极保护法。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 3b-a |
| 18 |
| 2a-3b |
| 36 |
| 3b-a |
| 18 |
| 2a-3b |
| 36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁、铝是现代金属材料的主角.
铁、铝是现代金属材料的主角.

查看答案和解析>>
科目:高中化学 来源: 题型:
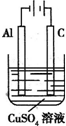 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com