
科目:高中化学 来源: 题型:选择题
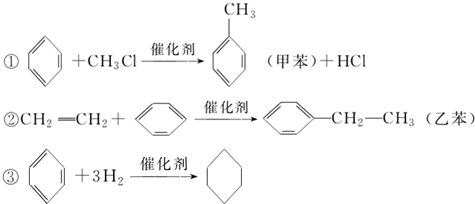
| A. | 反应①、②、③加成反应 | |
| B. | 溴水中加入苯,二者可发生取代反应 | |
| C. | 乙苯中所有碳原子一定在同一平面上 | |
| D. | 能用溴水判断反应②所得的乙苯中是否混有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、SO42- | B. | CO32-、Cl-、SO42- | C. | Ca2+、Br-、SO42- | D. | Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气与足量的铜充分反应 | B. | 0.2mol浓硫酸与足量铜反应 | ||
| C. | 46g金属钠与足量的水反应 | D. | 56g铁与足量稀硝酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧族元素包括氧、硫、锡、碲、钋 | |
| B. | Na2O2固体中的阳离子和阴离子个数比为1:1 | |
| C. | H、D、T、H+可以用来表示氢元素的四种同位素 | |
| D. | 表示金属元素名称的汉字不一定都含“钅”旁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
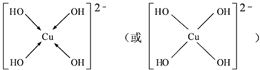 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>H2Se | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:I->Se2->Cl- | D. | 酸性:HBrO4>H2SeO4>HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com