
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ||||||
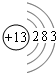 ,故答案为:
,故答案为: ;
;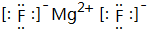 ,
,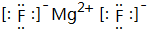 ;
;

科目:高中化学 来源: 题型:
| A、FeCl3 HCl NaCl NaOH |
| B、BaCl2 Na2CO3 HCl (NH4)2CO3 |
| C、HCl CuCl2 NaNO3 Na2SO4 |
| D、Na2CO3 Na2SO4 HCl H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤化氢分子中,卤素的非金属性越强,共价键的极性越强,分子越稳定 |
| B、以极性键结合的分子,不一定是极性分子 |
| C、判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称、键角小于180°的非直线形结构 |
| D、非极性分子中,各原子间都应以非极性键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑩ | |
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
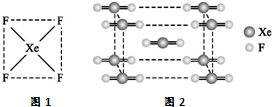 Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com