
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完反应,放出的热量为28.7 kJ | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 | |
| D. | 2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则碳的燃烧热等于 110.5 kJ/mol |
分析 A.固体硫燃烧时要先变为气态硫,过程吸热,据此确定反应热的大小;
B.反应过程中,反应物的物质的量之比等于热量比;
C.物质的能量越高越不稳定;
D.1mol可燃物完全燃烧生成稳定的氧化物放出的热量为燃烧热.
解答 解:A.固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生成气体产生热量多,但反应热为负值,所以△H1<△H2,故A错误;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.4 kJ/mol,即在稀溶液中1molNaOH完全反应放出57.4kJ热量,则含20 gNaOH即0.5mol的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ,故B正确;
C.C(石墨,S)=C(金刚石,S)△H=+l.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石的能量比石墨高,则石墨比金刚石稳定,故C错误;
D.2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,该反应方程式中C的物质的量为2mol,生成的氧化物为CO不是稳定氧化物,所以反应热不是碳的燃烧热,故D错误.
故选B.
点评 本题考查了反应热大小比较、中和热、燃烧热等,侧重于基础知识的考查,题目难度不大,注意把握燃烧热和中和热的概念.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:选择题
我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A.①中水银“积变又还成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1 mol磷酸吡醛与足量的金属钠反应,最多消耗2mol Na | |
| C. | 1 mol磷酸吡醛与NaOH溶液反应,最多消耗4mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| ③ | 0.2 | 0.1 | 4.8 |
| ④ | 0.1 | 0.2 | y |
| A. | 实验①反应后的溶液中:c(HA)约为$\frac{{K}_{W}}{1×1{0}^{-9}}$mol•L-1 | |
| B. | 实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| C. | 实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-) | |
| D. | 实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | Kal=4.4×10-7 Ka2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g O2与8 g O3均含有4 NA个电子 | |
| B. | 标准状况下,2.24 L SO3的分子数为0.1 NA | |
| C. | 1L 1mol•L-1盐酸中含有NA个HCl分子 | |
| D. | 0.1 mol Fe与足量浓HNO3反应,转移电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
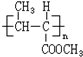 和高聚物H的合成路线如图:
和高聚物H的合成路线如图: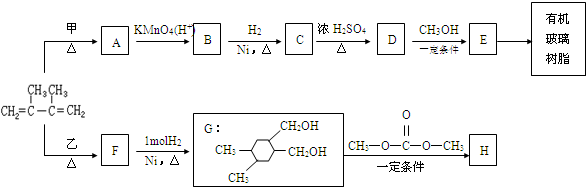
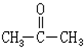 +CH3COOH
+CH3COOH
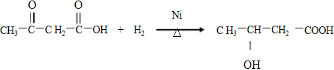 .
. .
.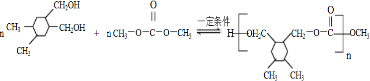 +(2n-1)CH3OH.
+(2n-1)CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH2-CH2-CH2-CH3 | B. | HC≡C-CH2-CH2-CH2-CH3 | ||
| C. |  | D. | 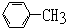 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com