
(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2 。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480 mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与(5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
科目:高中化学 来源:2011-2012学年重庆市西南大学附属中学高一上学期期末考试化学试卷 题型:填空题
(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480  mL, 应量取市售浓盐酸________mL进行配制。
mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与 (5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源:2012届三校上海市(复旦、交大、华师大二附中)高三联考化学试卷(带解析) 题型:实验题
(本题共12分)
某化学课外小组设计了如下图所示的装置进行实验。图中箭头表示气体流向。A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2 、NH4HCO3、碱石灰等固体和蒸馏水。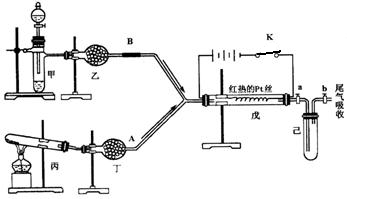
根据图中装置和反应现象请回答:
(1)丙中发生反应的化学方程式为 。
(2)丁中的干燥剂应选 ________,不选另一种干燥剂的由 。
(3)甲中发生反应的化学方程式为 。
(4)戊中发生的主要反应的化学方程式为____________________,此反应是________(吸热、放热)反应,能证明你的判断的现象是 。
(5)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将己浸入冰水中,则已中会出现的现象是:______________,产生此现象的原因: 。
查看答案和解析>>
科目:高中化学 来源:2012届河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:实验题
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为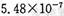 ,饱和亚硫酸中
,饱和亚硫酸中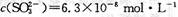 。
。
(1) 将0.1 mol ? L—1的BaCl2溶液滴入饱和亚硫酸中,_______ (填“能”或“不能”)生成BaSO3沉淀,原因是______________ (请写出必要的推断过程)。
(2) 浓硫酸的沸点为338°C,酒精灯火焰的温度为400?5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
(3) 乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。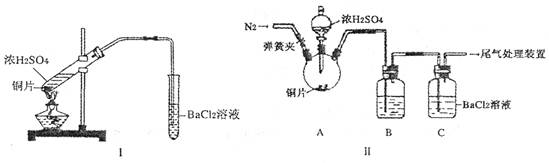
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4) 丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
| A.NaOH溶液 | B.Na[Al(OH)4]溶液 | C.H2O2溶液 | D.酸性 KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高一上学期期末考试化学试卷 题型:填空题
(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2 。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480 mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与 (5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com