
分析 (1)据pH计算溶液中c(H+)、c(OH-),酸碱混合呈中性,应满足V酸×c(H+)=V碱×c(OH-),以此解答该题;
(2)据pH计算溶液中c(H+)、c(OH-),酸碱混合呈中性,应满足V酸×c(H+)=V碱×c(OH-),以此解答该题.
(3)据pH计算溶液中c(H+)、c(OH-),酸碱混合呈中性,应满足V酸×c(H+)=V碱×c(OH-),以此解答该题.
(4)反应速率与氢离子浓度成正比,氢离子浓度越大,反应速率越快;充分反应后生成的氢气的量取决于溶液中含有的H+的总量;
(5)(1)Na2CO3在溶液中电离为钠离子和碳酸根,然后碳酸根在溶液中发生水解,水也能发生电离,据此分析;
(2)根据物质在溶液中的行为来判断粒子种类;
(3)①根据物质在溶液中的行为来判断粒子种类;
②根据溶液显电中性来分析;
③根据碳酸根后来能部分转化为HCO3-和H2CO3来分析;
④根据在碳酸钠溶液中,所有的氢离子和氢氧根均来自于水的电离来分析.
解答 解:(1)pH=12 的NaOH溶液c(OH-)=0.01mol/L,pH=2的HCl溶液c(H+)=0.01mol/L,混合后,溶液呈中性.则V1:V2=1:1,
故答案为:1:1;
(2)pH=12 的NaOH溶液c(OH-)=0.001mol/L,pH=2的HCl溶液c(H+)=0.01mol/L,混合后,溶液呈中性.则V1×c(H+)=V2×c(OH-),V1:V2=c(OH-):c(H+)=10:1,故答案为:10:1;
(3)pH=13 的NaOH溶液c(OH-)=0.1mol/L,pH=2的HCl溶液c(H+)=0.01mol/L,混合后,溶液呈中性.则V1×c(H+)=V2×c(OH-),V1:V2=c(OH-):c(H+)=1:10,故答案为:1:10.
(4)反应速率与氢离子浓度成正比,氢离子浓度越大,反应速率越快,当它们pH相同时,氢离子浓度相同,所以反应速率都相同;而由于硫酸和盐酸均为强电解质,完全电离,故溶液中的氢离子即为溶液中的全部氢离子,而醋酸是弱电解质,不能完全电离,故溶液中的氢离子是醋酸溶液中的部分氢离子,还有更多的氢离子未电离,即醋酸溶液中的氢离子的总量大于硫酸和盐酸,故和足量的锌反应是,生成的氢气的量:醋酸>H2SO4=HCl.
故答案为:H2SO4=HCl=醋酸;醋酸>H2SO4=HCl;
(5)(1)Na2CO3在溶液中电离为钠离子和碳酸根:Na2CO3=2Na++CO32-,而碳酸根在溶液中发生水解:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,水也能发生电离:H2O?H++OH-,
故答案为:Na2CO3=2Na++CO32-、CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-、H2O?H++OH-;
(2)根据物质在溶液中的行为可知溶液中的粒子种类有:Na+、CO32-、HCO3-、OH-、H+,故答案为:Na+、CO32-、HCO3-、OH-、H+;
(3)①根据物质在溶液中的行为可知,由于碳酸根在溶液中的水解分步进行,且以第一步为主,而溶液显碱性,故溶液中的c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+);
②根据溶液显电中性可知:c(Na+)+c(H+)=2(CO32-)+c(HCO3-)+c(OH-),故答案为:c(Na+)+c(H+)=2(CO32-)+c(HCO3-)+c(OH-);
③由于碳酸根后来能部分转化为HCO3-和H2CO3,故根据物料守恒可知:c(Na+)=2[CO32-)+c(HCO3-)+c(H2CO3)],故答案为:c(Na+)=2[CO32-)+c(HCO3-)+c(H2CO3)];
④由于在碳酸钠溶液中,所有的氢离子和氢氧根均来自于水的电离,且水电离出的氢离子浓度等于水电离出的氢氧根浓度,故有:c(OH-)=c(HCO3-)+2(H2CO3)+c(H+),故答案为:c(OH-)=c(HCO3-)+2(H2CO3)+c(H+).
点评 本题考查了弱电解质的电离和盐溶液中的三个守恒,会分析等物质的量浓度的不同酸时溶液 pH的相对大小,等pH时不同酸溶液的物质的量浓度相对大小,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 ,说法正确的是( )
,说法正确的是( )| A. | 该有机物属于脂肪烃 | |
| B. | 该有机物的分子式为:C12H14 | |
| C. | 该有机物可与5molH2发生加成反应 | |
| D. | 分子中,处于同一平面上的碳原子数最多可能有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液漏斗可用于分离苯和水,且苯层由分液漏斗的下口流出 | |
| B. | 利用丁达尔效应可以区分溶液与胶体 | |
| C. | 用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,没有钾元素 | |
| D. | 配制硫酸溶液时,可先在容量瓶中加入一定体积的浓硫酸,再在搅拌下慢慢加入水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 | |
| B. | PM2.5是指氰、硫的氧化物溶于水形成的酸性液态造成的空气污染 | |
| C. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| D. | 在食品袋长放入盛有硅胶的透气袋,可防止食物氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质本身不一定能导电 | |
| B. | 溶液中离子数越多,导电性就越强 | |
| C. | 溶于水后能电离出H+的化合物都是酸 | |
| D. | 电解质在水溶液里或熔融状态下能够导电,说明电解质本身必须含有阴阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
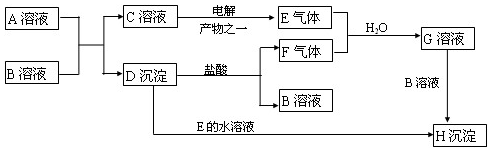
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 4 | C. | 3 | D. | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com