
| A、向水中通入氯气:Cl2+H2O═2H++Cl-+ClO- |
| B、向氯化铁溶液中加入铜:2Fe3++3Cu═2Fe+3Cu2+ |
| C、将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、镁和稀硝酸反应:Mg+2H+═Mg2++H2↑ |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
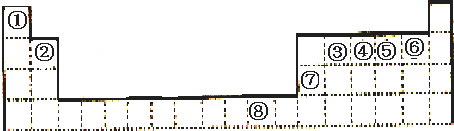
| A、①② | B、②③⑤ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
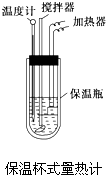 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0L | B、2.24L |
| C、3.36L | D、4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ |
| C、在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
| D、向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-═Fe4[Fe(CN)6]2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| B、做本实验的当天室温较高 |
| C、将50mL 0.55mol?L-1的氢氧化钠溶液取成了50mL 0.55mol?L-1的氨水 |
| D、在量取盐酸时仰视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等物质的量浓度的NaHCO3与Na2CO3溶液等体积混合,所得混合液中有:c(CO32-)+2c(OH-)═2c(H+)+c(HCO3-)+3c(H2CO3) |
| B、1L pH=3的H2SO4溶液与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
| C、NaHS溶液呈碱性,是因HS-发生水解,其水解离子方程式为:HS-+H2O?S2-+H3O+ |
| D、pH=9的CH3COONa溶液和pH=9的NH3?H2O溶液,两溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com