
(10分)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 炭粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 |
| 36.0 |
③ |
| 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中的压强随时间的变化如图(a)所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图(b)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是__________。
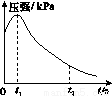

(a) (b)
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,补全实验步骤和结论。
实验步骤和结论
①药品用量和操作同编号①实验(多孔橡皮塞增加进、
出导管);
②通入氩气排净瓶内空气;
③ 。
(1)
(2)吸氧  还原 2H2O + O2+4e-=4OH-,
还原 2H2O + O2+4e-=4OH-,
(3)反应放热,温度升高
(4)③滴入醋酸溶液,同时测量瓶内压强变化(也可测温度变化,检验铁离子等)。如果瓶内压强增大,假设一成立,否则假设一不成立。
【解析】
试题分析:(1)实验②是测定醋酸浓度的影响,其他条件不变,所以铁粉的质量仍是2.0g;实验③中,醋酸和铁粉的量不变,而C粉的质量变化,说明该组实验是测定炭粉含量对电化学腐蚀的影响;
(2)压强减小,说明容器内的气体参加了反应,说明该腐蚀是吸氧腐蚀;金属腐蚀中,Fe失去电子,所以电子的移动方向是 由铁指向碳,如图 ;C极作原电池的正极,氧气在该极发生还原反应,电极反应式为2H2O + O2+4e-=4OH-,
;C极作原电池的正极,氧气在该极发生还原反应,电极反应式为2H2O + O2+4e-=4OH-,
(3)0~t1时压强变大,可能的原因是发生析氢腐蚀,使压强增大,或是该反应是放热反应,温度升高,压强增大;
(4)③发生析氢腐蚀的条件是溶液为酸性,则滴入醋酸溶液,同时测量瓶内压强变化,若压强增大,则说明假设一成立,反之不成立。或者将锥形瓶内的溶液过滤,取部分滤液,向其中加入KSCN溶液,溶液不变红色,再加入新制氯水,溶液变红色,则说明假设一正确,反之不正确。
考点:考查金属的电化学腐蚀实验,对实验的分析、设计


科目:高中化学 来源:2014-2015安徽省高二上学期第一次质量检测化学试卷(解析版) 题型:填空题
(9分)根据下列氧化还原反应2FeCl3+Cu===2FeCl2+CuCl2设计一个原电池:

请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________;
(2)银电极为电池的________极,发生的电极反应为_________________________;
X电极上发生的电极反应为_________________________;
(3)外电路中的电子是从________电极流向________电极(填具体电极如Ag”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高二上学期期中化学试卷(解析版) 题型:选择题
下列事实,不能用勒夏特列原理解释的是
A.氨水中加酸,NH的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500 ℃左右的温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高一上学期期中化学试卷(解析版) 题型:选择题
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是

A.蒸馏、蒸发、萃取、过滤 B.蒸馏、过滤、萃取、蒸发
C.萃取、过滤、蒸馏、蒸发 D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高一上学期期中化学试卷(解析版) 题型:选择题
溶液、胶体和浊液这三种分散系的本质区别是
A.是否有丁达尔现象 B.是否能通过滤纸
C.分散质粒子的大小 D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF)
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
Mg?AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为
2AgCl+ Mg === Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
有关甲、乙、丙、丁四个图示的叙述正确的是
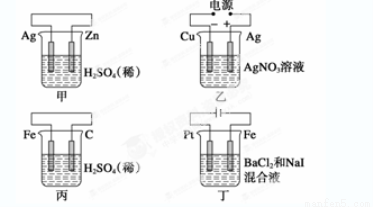
A.甲中负极反应式为2H++2e-===H2↑
B.乙中阳极反应式为Ag++e-===Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:填空题
(11分)高炉炼铁过程中发生的主要反应为:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
 Fe(s)+CO2(g).该反应在不同
Fe(s)+CO2(g).该反应在不同
温度下的平衡常数如下:请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A减少Fe的量 B增加Fe2O3的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com