
在微生物作用下,NH4+经过两步反应被氧化成NO3﹣.反应的能量变化示意图如下:
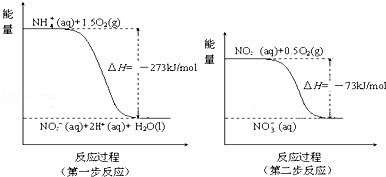
①第一步反应是 反应(选填“放热”或“吸热”),判断依据是 .
②1mol NH4+(aq)全部氧化成NO3﹣(aq)的热化学方程式是 .
考点: 反应热和焓变.
专题: 化学反应中的能量变化.
分析: ①当反应物的总能量大于生成物的总能量,反应是放热的;
②结合图象根据盖斯定律来计算反应的焓变.
解答: 解:①焓变小于0,则反应为放热反应,故答案为:放热;因为△H=﹣273kJ/mol<0(反应物的总能量大于生成物的总能量);
②第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2﹣(aq)+2H+(aq)+H2O(l),△H=﹣273KJ/mol,第二步的热化学方程式为:NO2﹣(aq)+0.5O2(g)═NO3﹣(aq),△H=﹣73KJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3﹣(aq),△H=﹣346 kJ/mo l
l
,故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3﹣(aq),△H=﹣346 kJ/mol.
点评: 本题是一道有关化学反应中的能量变化和热化学方程式的题目,综合性强,难度较大.


科目:高中化学 来源: 题型:
铅蓄电池是工作时的电池反应为:PbO2+2H2SO4⇌2PbSO4+2H2O;试回答:
(3)铅蓄电池正极的电极材料是 .
(4)工作时该铅蓄电池负极的电极反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
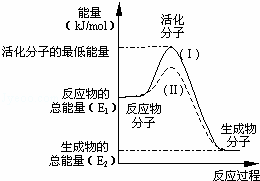
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察下图,然后回答问题.
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H= (用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+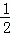 O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1mL 1.0mol•L﹣1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示
mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示 (实验中始终保持V1+V2=50mL).下列叙述正确的是()
(实验中始终保持V1+V2=50mL).下列叙述正确的是()
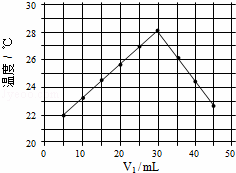
A. 做该实验时环境温度为20℃
B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0mol/L•L﹣1
D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
请回答下列问题:
(1)该反应的化学方程式为 .
(2)若t2=2min,N的平均反应速率为 .
(3)在t3时刻v正 (填“>”、“<”或“=”)v逆.
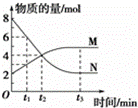
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某一达到平衡状态的可逆反应,如果改变某一条件而使生成物浓度增大,则()
A. 平衡一定向正反应方向发生了移动
B. 平衡一定向逆反应方向发生了移动
C. 反应物浓度相应减小
D. 平衡可能发生了移动,也可能没有发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法中,正确的是()
A. 100mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
下面对氯气的叙述正确的是()
A. 因为氯气有毒,所以氯气可用于自来水的杀菌消毒
B. 氯气可使湿润的红布条退色,但氯气本身不具有漂白性
C. 在通常情况下,氯气可以和任何金属直接化合
D. 闻其气味时要小心将集气瓶放在鼻孔下直接闻
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com