
分析 pH均为11的氨水与NaOH溶液中,氢氧根的浓度均为0.001mol/L,而氢氧化钠是强电解质,加水稀释时溶液中氢氧根浓度几乎是直线下降,pH下降较快;而一水合氨为弱电解质,存在电离平衡,故当加水稀释时电离平衡被促进,据此分析溶液中pH变化.
解答 解:pH均为11的氨水与NaOH溶液中,氢氧根的浓度均为0.001mol/L,而氢氧化钠是强电解质,加水稀释时溶液中氢氧根浓度几乎是直线下降,pH下降较快;而一水合氨为弱电解质,存在电离平衡,故当加水稀释时电离平衡被促进,故溶液pH下降较慢,但无论是氢氧化钠溶液还是氨水,稀释后溶液的pH会永远大于7,如图所示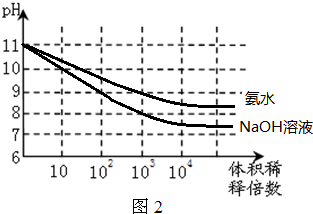 ,故答案为:
,故答案为: .
.
点评 本题考查了强碱和弱碱加水稀释后pH变化规律,难度不大,应注意的是pH相同的氢氧化钠溶液和氨水溶液中,氢氧根的浓度相同,当加水稀释时,氨水的电离平衡被促进.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | Na2O+H2O═2NaOH | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ①③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 再加300mL 1 mol•L-1盐酸 | ||
| C. | 用等量铁片代替铁粉 | D. | 改用100mL 98%的硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molBr-完全转化为BrO3-,得到6 mol电子 | |
| B. | 该过程中溴化物发生氧化反应,臭氧发生还原反应 | |
| C. | 该过程中溴元素被还原,氧元素被氧化 | |
| D. | 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在Ag+ | B. | 一定存在CO32- | C. | 一定存在SO42- | D. | 以上说法都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与水反应,转移电子1 mol | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| C. | 钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH | |
| D. | 将Na2O2加入酚酞试液中,得到红色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
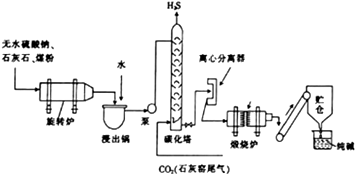 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com