
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择仪器;
(2)依据m=CVM计算需要溶质的质量;
(3)依据容量瓶构造及使用方法解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容等,用到的仪器:
托盘天平、药匙、500mL容量瓶、烧杯、玻璃棒、胶头滴管;
故答案为:500mL容量瓶;烧杯;玻璃棒;胶头滴管;
(2)用NaOH固体配制1.0mol/L的NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=1.0mol/L×40g/mol×0.5L=20.0g;
故答案为:20.0;
(3)容量瓶带有活塞,使用前需要检查是否漏水;
故答案为:查漏;
(4)在配制过程中,如果没有洗涤烧杯和玻璃棒,导致溶质损耗,溶质的物质的量偏小,依据C=$\frac{n}{V}$可知溶液浓度偏小,
故答案为:小于.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意容量瓶的构造及使用方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物的年代鉴定,14C与12C互为同素异形体 | |
| B. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 服用铬含量超标的药用胶囊会对人体健康造成危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
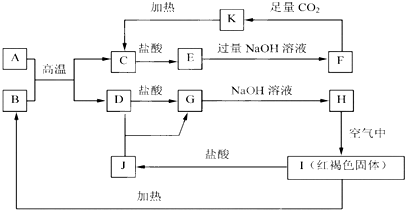
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是还原产物 | |
| B. | 负极的电极反应为:Ag+Cl--e-═AgCl | |
| C. | Na+不断向“水”电池的正极移动 | |
| D. | 每生成1mol Na2Mn5O10转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
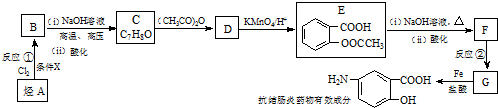
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$ (b)
(b)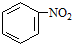 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
 ;
;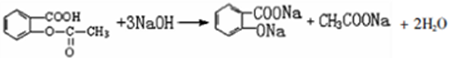 ;
; ;
; )易被氧化,苯环上连有烷基时再引入一个取代基,常取代
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代 ) 合成路线中两种中间产物的结构简式(部分反应条
) 合成路线中两种中间产物的结构简式(部分反应条 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
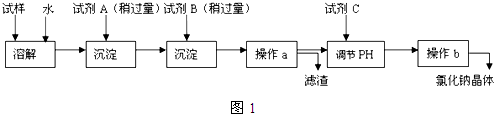
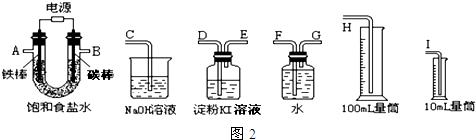
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
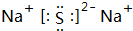 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图1装置测定中和热的实验步骤如下:
利用如图1装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com