
| A、②③⑦ | B、②④⑥ |
| C、②④⑤ | D、②⑤⑦ |


科目:高中化学 来源: 题型:
| A、硫化钠溶于水中:S2-+2H2O?H2S+2OH- |
| B、醋酸溶解鸡蛋壳:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+H2O |
| C、NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D、NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气的燃烧热△H=-241.8kJ?mol-1 |
| B、相同条件下,充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1molH2S(g)放热多20.1kJ |
| C、由①②知,水的热稳定性小于硫化氢 |
| D、②中若生成固态硫,△H将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
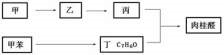
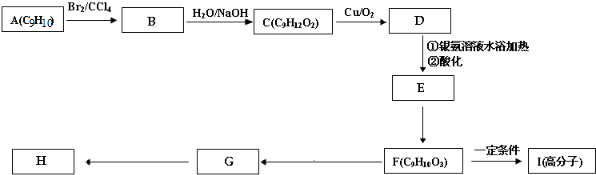
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
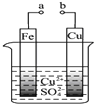
| A、构成原电池时Cu极反应为:Cu-2e-=Cu2+ |
| B、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| C、要使Fe极不被腐蚀,Cu片换Zn片或将a与直流电源的负极相连 |
| D、a和b分别连接直流电源正、负极,Fe片上有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com