
| ||
| ||

| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
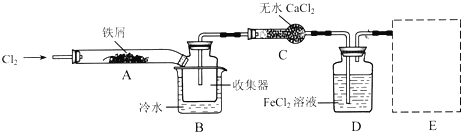
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用干冰保藏易变质的食品 |
| B、用硫磺熏制白木耳、粉丝等食品 |
| C、用甲醛浸泡易腐烂的食品 |
| D、用含亚硝酸钠的工业用盐腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
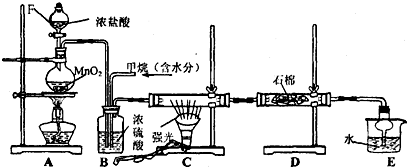
查看答案和解析>>
科目:高中化学 来源: 题型:
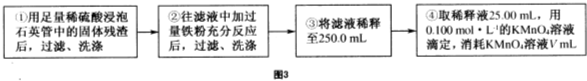
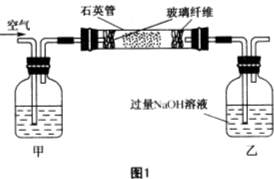 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
| ||
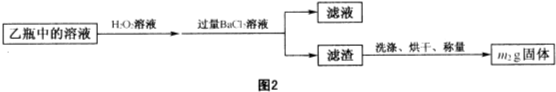
- 4 |
查看答案和解析>>
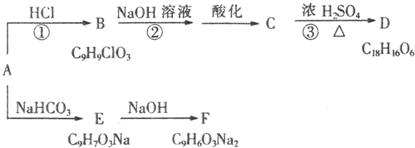
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度计的水银球应插入蒸馏烧瓶内的自来水中 |
| B、冷凝管内水的流向是下进上出 |
| C、实验中需在自来水中加几片碎瓷片 |
| D、蒸馏烧瓶底部必须垫石棉网 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com