
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
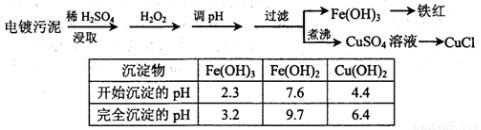
(1)酸浸后加入H2O2的目的是?????????? 。调pH步骤中加入的试剂最好是???????? (填化学式)。实验室进行过滤操作所用到的玻璃仪器有?????????????? 。
(2)煮沸CuSO4溶液的原因是????????????????? 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式???????????? 。
(3)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数?? 。
(4)Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数表达式为??????????? 。
Fe(OH)3+3H+,该反应的平衡常数表达式为??????????? 。
(1)将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离;CuO或Cu(OH)2等;漏斗、烧杯、玻璃棒
(2)除净溶液中的H2O2,避免影响下一步CuCl的生成
2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4
(3)99.50%? (4)K=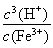
【解析】
试题分析:由于在电镀污泥中含有铜、铁等金属化合物。所以加入稀硫酸能与Fe及金属氧化物发生反应,产生溶解于水的物质,除去难溶性的杂质。再加入H2O2,可以把Fe2+氧化为Fe3+.便于调整溶液的pH值试纸与Cu2+进行分离。既能降低溶液的酸性,又不引入新的杂质,应该加入的物质金属阳离子与溶液中的相同即可。如加入CuO或Cu(OH)2、CuCO3等. 在实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、玻璃棒。(2)在用稀硫酸溶解后的溶液中加入了有强氧化性的H2O2,如果不除去,会使制取的CuCl被氧化变质。所以要将CuSO4溶液煮沸来驱赶H2O2。向CuSO4溶液中加入一定量的NaCl、Na2SO3,生成白色的CuCl沉淀的化学方程式为2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4。(3)由方程式可得关系式为CuCl——Fe2+——Ce4+。n(Ce4+)=n(CuCl)= c·V=0.1000mol/L ×0.025L= 2.5×10-3mol.所以m=n·M=2.5×10-3mol×99. 5=0.24875g.所以该CuCl样品的质量分数为:(0.24875÷ 0.2500g)×100%=99.50%。(4)化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与个反应物浓度的幂指数乘积的比。因此该水解反应飞平衡常数K=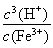 。
。
考点:考查化学实验基本操作、化学平衡常数的表达式、物质的纯度的计算及工业流程的知识。


科目:高中化学 来源:2012-2013学年广东省深圳市南山区高三上学期期末考试化学试卷(解析版) 题型:填空题
铬及其化合物在现代工业上的应用广泛,可用于电镀,鞣制羊毛,皮革;铬还用于照相材料,胶版印刷及化工触媒剂等。但化工废料铬渣对人体健康有很大危害。
Ⅰ:某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
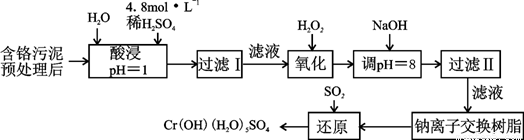
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
|
沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施是 (至少答一点)。
(3)调节溶液的pH=8是为了除去 离子。钠离子交换树脂的原理为:
Mn++nNaR→MRn+nNa+,被交换的的杂质离子是 。
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)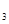 的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
(5)还原过程发生以下反应(请配平): Na2Cr2O7+ SO2+
= Cr(OH) (H2O)5SO4+ Na2SO4;
Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。
其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe做电极的原因为
在阴极附近溶液pH升高的原因是(用电极反应解释) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com