
【题目】有硫酸与硝酸的混合液,取出其中10 mL,加入足量的BaCl2溶液,将生成的沉淀过滤洗涤,干燥称得质量为9.32 g。另取这种溶液10 mL与4 mol·L-1的NaOH溶液25 mL恰好中和。计算:
(1)混合液中H2SO4的物质的量浓度是______
(2)混合液中HNO3的物质的量浓度是______
(3)另取10 mL的混合液与0.96 g铜粉共热时,产生气体在标准状况体积是______L?
【答案】4mol/L 2mol/L 0.224
【解析】
(3)Cu与稀硝酸反应的化学方程式:![]() ,判断反应的过量问题,根据不足量的物质计算生成NO体积;
,判断反应的过量问题,根据不足量的物质计算生成NO体积;
(1)①混合酸中只有硫酸和氯化钡反应生成沉淀,反应式为:
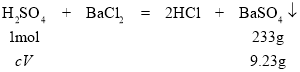 ,则有
,则有![]() ,混合液中硫酸的物质的量浓度是4mol/L;
,混合液中硫酸的物质的量浓度是4mol/L;
(2)强酸和氢氧化钠反应的离子方程式为H++OH-=H2O。恰好反应,说明氢离子的物质的量和OH-的物质的量相等,所以有4.0mol/L×0.01L×2+c(HNO3)×0.01L=4.0mol/L×0.025L,解得c(HNO3)=2.0mol/L,则混合液中硝酸的物质的量浓度是2mol/L;
(3)0.96g铜是![]() ,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.04mol×2+0.02mol=0.1mol.硝酸和铜反应的离子方程式为
,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.04mol×2+0.02mol=0.1mol.硝酸和铜反应的离子方程式为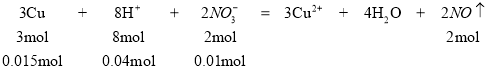 ,所以硝酸根和氢离子是过量的,Cu是不足的,所以生成NO的物质的量是
,所以硝酸根和氢离子是过量的,Cu是不足的,所以生成NO的物质的量是![]() ,
,
其标准状况下的体积是0.01mol×22.4L/mol=0.224L。


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )

①铜电极的质量减少②正极反应为Ag++e-=Ag ③在外电路中,电流由铜电极流向银电极 ④实验过程中取出盐桥,原电池仍继续工作
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是___________价,其基态原子电子排布式为___________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是___________。
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为___________。
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为___________。但NF3不易与Cu2+形成化学键,其原因是___________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为___________。
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为___________个,二者的最短距离为___________pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是

A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分键能数据如下:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH为( )
Si(s)+4HCl(g),该反应的反应热ΔH为( )
A.+412 kJ·mol-1B.+236 kJ·mol-1C.-412 kJ·mol-1D.-236 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的主要反应及能量变化如图:

回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,该反应必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)___(填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是_______。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强p1、p2分别为1×104 Pa和1×105 Pa)。

①1×104 Pa时,如图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为____。
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是__________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0kJ/mol、△H =-285.8kJ/mol。
①反应(ⅰ)的化学方程式为_____。
②25℃时,该工艺总反应的热化学方程式为________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

其中平衡(Ⅰ)隔板在2.8处,平衡(Ⅱ)隔板在2.6处。
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(Ⅰ)时,X的转化率为5/6
C.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D.对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10 :11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
A.充分反应后,X的转化率和Y的转化率不相等,前者大于后者
B.当反应达到平衡状态时,W与M的物质的量浓度之比一定为2:1
C.当混合气体的密度不再改变,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com