
·ÖĪö ¢ŁC£Øs£¬ŹÆÄ«£©+O2£Øg£©=CO2£Øg£©”÷H1=-400kJ•mol-1£»
¢Ś2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H2=-570kJ•mol-1£»
¢Ū2C2H2£Øg£©+5O2£Øg£©=4CO2£Øg£©+2H2O£Øl£©”÷H3=-2600kJ•mol-1£»
ŅĄ¾ŻøĒĖ¹¶ØĀÉ¢Ł”Į4+¢Ś-¢ŪµĆµ½£ŗ4 C£Øs£¬ŹÆÄ«£©+2H2£Øg£©=2C2H2£Øg£©¾Ż“Ė¼ĘĖć£®
½ā“š ½ā£ŗ¢ŁC£Øs£¬ŹÆÄ«£©+O2£Øg£©=CO2£Øg£©”÷H1=-400kJ•mol-1£»
¢Ś2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H2=-570kJ•mol-1£»
¢Ū2C2H2£Øg£©+5O2£Øg£©=4CO2£Øg£©+2H2O£Øl£©”÷H3=-2600kJ•mol-1£»
ŅĄ¾ŻøĒĖ¹¶ØĀÉ¢Ł”Į4+¢Ś-¢ŪµĆµ½£ŗ4 C£Øs£¬ŹÆÄ«£©+2H2£Øg£©=2C2H2£Øg£©”÷H=+430kJ•mol-1£»
Š“³ö298KŹ±ÓÉC£Øs£¬ŹÆÄ«£©ŗĶH2£Øg£©Éś³É1 mol C2H2£Øg£©·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ2 C£Øs£¬ŹÆÄ«£©+H2£Øg£©=C2H2£Øg£©”÷H=+215kJ•mol-1£»
¹Ź“š°øĪŖ£ŗC£Øs£¬ŹÆÄ«£©+2H2£Øg£©=C2H2£Øg£©”÷H=+215kJ•mol-1£®2C£Øs£¬ŹÆÄ«£©+H2£Øg£©=C2H2£Øg£©”÷H=+215 kJ•mol-1£®
µćĘĄ ±¾Ģāæ¼²éĮĖøĒĖ¹¶ØĀɵÄÓ¦ÓĆŗĶČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£¬ĢāÄæÄŃ¶Č²»“ó£¬Ć÷Č·øĒĖ¹¶ØĀɵÄŗ¬ŅåŗĶČČ»Æѧ·½³ĢŹ½µÄŹéŠ“·½·Ø¼“æɽā“š£¬×¢Ņā½Ģ²ÄÖŖŹ¶µÄĮé»īÓ¦ÓĆŹĒ½āĢā¹Ų¼ü£¬²ąÖŲÓŚæ¼²éѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£®


 ÖŠæ¼½ā¶Įæ¼µć¾«Į·ĻµĮŠ“š°ø
ÖŠæ¼½ā¶Įæ¼µć¾«Į·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “ÓæŖŹ¼µ½Ę½ŗā£¬AµÄ·“Ó¦ĖŁĀŹĪŖ0.08mol•L-1•min-1 | |
| B£® | Ėę×Å·“Ó¦µÄ½ųŠŠ£¬»ģŗĻĘųĢåµÄĆܶČÖš½„¼õŠ” | |
| C£® | “ļµ½Ę½ŗāŹ±£¬BµÄ×Ŗ»ÆĀŹĪŖ20% | |
| D£® | øĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżK=$\frac{20}{3}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¾Ū³Į | B£® | µēÓ¾ | C£® | ÉųĪö | D£® | ¹żĀĖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ė«ŃõĖ®±»³ĘĪŖĀĢÉ«Ńõ»Æ¼Į£¬ŹĒŅņĪŖĘ仹Ō²śĪļĪŖO2£¬¶Ō»·¾³Ć»ÓŠĪŪČ¾ | |
| B£® | ĶõĖ®ŹĒÅØŃĪĖįŗĶÅØĻõĖį°“Ģå»ż±Č1£ŗ3Åä³ÉµÄ»ģŗĻĪļ£¬æÉŅŌČܽāAu”¢Pt | |
| C£® | ŠĀÖʱøµÄĀČĖ®ÖŠ“ęŌŚĘßÖÖĮ£×Ó | |
| D£® | °±Ė®Äܵ¼µē£¬ĖµĆ÷°±ĘųŹĒµē½āÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
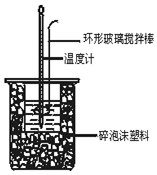 ¢ń”¢ŅŃÖŖ KIČÜŅŗŌŚĖįŠŌĢõ¼žĻĀÄÜÓėŃõĘų·“Ó¦£® ĻÖÓŠŅŌĻĀŹµŃé¼ĒĀ¼£ŗ
¢ń”¢ŅŃÖŖ KIČÜŅŗŌŚĖįŠŌĢõ¼žĻĀÄÜÓėŃõĘų·“Ó¦£® ĻÖÓŠŅŌĻĀŹµŃé¼ĒĀ¼£ŗ| ŹµŃ鱹ŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü | ¢Ż |
| ĪĀ¶Č£Ø”ę£© | 30 | 40 | 50 | 60 | 70 |
| ĻŌÉ«Ź±¼ä£Øs£© | 160 | 80 | 40 | 20 | 10 |
| ŹµŃéŠņŗÅ | ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ¶Čt2/”ę | |
| ŃĪĖį | ĒāŃõ»ÆÄĘ | »ģŗĻČÜŅŗ | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
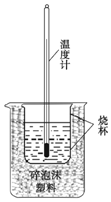 ŹµŃéŹŅĄūÓĆČēĶ¼×°ÖĆ½ųŠŠÖŠŗĶČČµÄ²ā¶Ø£® »Ų“šĻĀĮŠĪŹĢā£ŗ
ŹµŃéŹŅĄūÓĆČēĶ¼×°ÖĆ½ųŠŠÖŠŗĶČČµÄ²ā¶Ø£® »Ų“šĻĀĮŠĪŹĢā£ŗ| ·“Ó¦Īļ | ĘšŹ¼ĪĀ¶Č£Ø”ę£© | ÖÕĮĖĪĀ¶Č£Ø”ę£© | ÖŠŗĶČČ£ØkJ•mol-1£© |
| ¢ŁHCl+NaOH | 13 | 19.8 | -a |
| ¢ŚHCl+NH3•H2O | 13 | 19.3 | -b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | m-0.48 | B£® | m-0.72 | C£® | m-0.8 | D£® | m-1.2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com