
| A. | NO | B. | N2O | C. | N2O3 | D. | N2 |
分析 0.5mol硝酸铵,反应前各种原子的量:1mol N,2mol H,1.5mol O;反应后生成的水中含有的原子:$\frac{18g}{18g/mol}$×2=2mol H,$\frac{18g}{18g/mol}$=1molO,所以未知气体中含有:N原子为1mol,O原子为0.5mol,不含H原子,据此判断.
解答 解:18g水的物质的量为$\frac{18g}{18g/mol}$=1mol,
反应前0.5mol硝酸铵含有的各种原子的物质的量:
N原子0.5mol×2=1mol,H原子0.5mol×4=2mol,O原子0.5mol×3=1.5mol;
反应后生成水中含有的原子:
H原子1mol×2=2mol,O原子1mol×1=1mol.
所以未知气体中含有:N原子1mol,O原子为1.5mol-1mol=0.5mol,不含H原子;
所以未知气体为N2O.
故选:B.
点评 考查原子守恒的计算,难度不大,关键根据原子守恒判断未知气体中元素种类及原子个数比.


科目:高中化学 来源: 题型:填空题
 Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)
Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
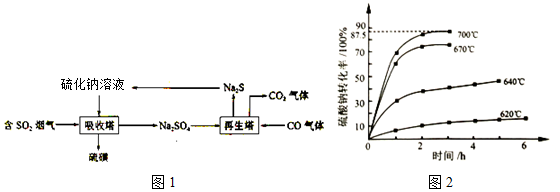
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s 浓度 | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3 s时反应已经停止 | |
| B. | t3~t4 s内正、逆反应速率不相等 | |
| C. | 在容器中发生的反应为A(g)+B(g)??C(g) | |
| D. | 在t2~t3 s内A的平均反应速率为$\frac{1}{{t}_{3}-{t}_{2}}$ mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com