
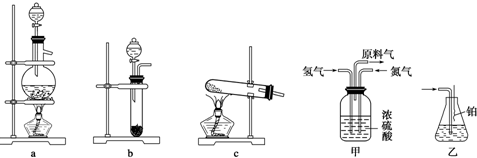
分析 (1)实验室是利用固体氢氧化钙和氯化铵固体加热反应生成氨气,选择仪器应是固体和固体加热制备气体的装置,在大试管中加热实现气体制取;
(2)①实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热反应制取氮气,反应生成氮气、氯化钠和水;
②氨的催化氧化生成一氧化氮和水;
③根据溶液的组成来确定含有的离子,氨的催化氧化反应产物是一氧化氮和水,一氧化氮极易变为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,所以硝酸的存在会和氨水反应生成硝酸铵;
(3)氮气和氧气放电条件下反应生成一氧化氮;
(4)CO和NO在催化剂作用下反应生成无污染的二氧化碳和氮气.
解答 解:(1)实验室是利用固体氢氧化钙和氯化铵固体加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,选择仪器应是固体和固体加热制备气体的装置,图中c装置符合,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;c;
(2)①实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热反应制取氮气,反应生成氮气、氯化钠和水,反应的化学方程式为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,故答案为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
②氨的催化氧化反应,-3价的氮为氧化成+2价,产物是一氧化氮和水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
③氨的催化氧化反应产物是一氧化氮和水,一氧化氮极易变为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,所以硝酸的存在会和氨水反应生成硝酸铵,溶液中会存在H+、OH-、NH4+、NO3-,
故答案为:NH4+;NO3-;
(3)氮气和氧气放电条件下反应生成一氧化氮,反应的化学方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(4)在汽车尾气系统中装置催化转化器可减少CO和NO的污染,该化学反应方程式为:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$N2+CO2,
故答案为:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$N2+CO2.
点评 本题是一道关于氨气的制取和性质知识的综合题目,要求学生具有分析和解决问题的能力,综合性强.主要是装置选择分析、反应方程式的书写,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
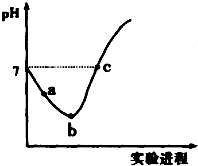 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| D. | c 点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
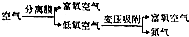
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
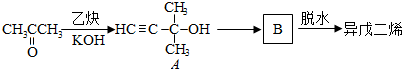
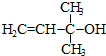 .
. 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
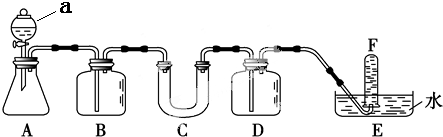
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和碳酸氢钠溶液 | |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶液在电流作用下电离成钾离子和氯离子 | |
| B. | 二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质 | |
| C. | 纯净的电解质在液态时,有的导电有的不导电 | |
| D. | 硫酸钡难溶于水,所以硫酸钡属弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
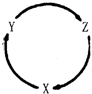 下表各组物质中,满足右图物质一步转化关系的选项是( )
下表各组物质中,满足右图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Al | AlCl3 | Al(OH)3 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③④ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com