
��16�֣������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1���ҹ���������̼���о���ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼
�����������ʣ�������̼���������������������ᴿ���䷴Ӧ�Ļ�ѧ����ʽΪ��
___C + ___K2Cr2O7 + _______= ___ CO2�� + ___K2SO4 + ___Cr2(SO4)3 +___H2O
����ɲ���ƽ������ѧ����ʽ��
��2����ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO(g)+ 2H2(g)  CH3OH(g)
��H1����116 kJ��mol-1
CH3OH(g)
��H1����116 kJ��mol-1
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ���____________��
A��ʹ�ø�Ч���� B�����ͷ�Ӧ�¶�
C��������ϵѹǿ D�����Ͻ�CH3OH�ӷ�Ӧ������з������
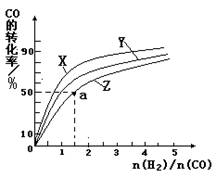
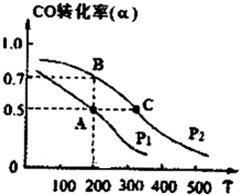
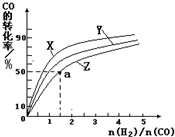
���ں��������кϳɼ״������¶ȷֱ�Ϊ230�桢250���270��ʱ��CO��ת������n(H2)/n(CO)����ʼ��ɱȵĹ�ϵ����ͼ��ʾ����֪�������1L����ʼʱCO�����ʵ�����Ϊ1mol���ݴ��ж������������¶��У�����Z��Ӧ���¶���__________������ͼ��a���Ӧ�����ݣ�����÷�Ӧ�ڶ�Ӧ�¶��µ�ƽ�ⳣ��K =_______________________��
����֪��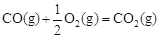 ��H2����283 kJ��mol-1
��H2����283 kJ��mol-1
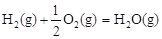 ��H3����242 kJ��mol-1
��H3����242 kJ��mol-1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ�������Ȼ�ѧ����ʽΪ_________��
��3��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ����ܶȻ�����Ksp=
c(Ca2+)��c(CO32��)=2.8��10−9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ5.6��10 -5 mol/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ________________________��
��1��3C + 2K2Cr2O7 +8H2SO4 = 3CO2�� + 2K2SO4 + 2Cr2(SO4)3 +8H2O��3�֣�����H2SO4��1�֣�
��2����AC��2�֣���1�֣���ѡ���ѡ1������1�֣�����Ϊֹ�����������֣�
��270�棨2�֣���λ��1�֣� 4L2/mol2��3�֣���д��λҲ���֣�
��CH3OH(g)+3/2O2(g)
 CO2(g)+2H2O(g)
��H����651kJ��mol-1��3�֣�
CO2(g)+2H2O(g)
��H����651kJ��mol-1��3�֣�
��3��2��10-4mol/L��3�֣���д��λ��1�֣�
����������1������������ԭ��Ӧ����ʽ����ƽ����ƽ�������ǵ��ӵĵ�ʧ�غ㡣̼�ǻ�ԭ�������ϼ�����4����λ��K2Cr2O7 ������������Ԫ�صĻ��ϼ۽���3����λ������1mol�������õ�6mol���ӣ����������ͻ�ԭ�������ʵ���֮����2�U3�����Է���ʽΪ3C + 2K2Cr2O7 +8H2SO4 = 3CO2�� + 2K2SO4 + 2Cr2(SO4)3 +8H2O��
��2���ٿ�����������Է�Ӧ���ʵ�Ӱ�졣����ѹǿ��ʹ�ô�����������Ӧ���ʣ�AC��ȷ��BD�ǽ��ͷ�Ӧ���ʡ�
�������Ƿ��ȷ�Ӧ�������¶�Խ�ߣ�CO��ת����Խ�͡����Z��ʾ����270�档a���ת������50����CO����ʼŨ����1������������1.5�����ĵ�COŨ����0.5��������1�����ɼ״���0.5������ƽ�ⳣ����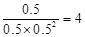 ��
��
�ۿ����˹���ɵ�Ӧ�á����ݷ�Ӧ��CO(g)+ 2H2(g)  CH3OH(g)����
CH3OH(g)����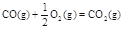
��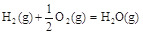 ��֪���ڣ��٣��ۡ�2�ɵ�H3OH(g)+3/2O2(g)
��֪���ڣ��٣��ۡ�2�ɵ�H3OH(g)+3/2O2(g)  CO2(g)+2H2O(g)�����Է�Ӧ���ǣ�283 kJ��mol-1��116 kJ��mol-1��242 kJ��mol-1��2����651kJ��mol-1��
CO2(g)+2H2O(g)�����Է�Ӧ���ǣ�283 kJ��mol-1��116 kJ��mol-1��242 kJ��mol-1��2����651kJ��mol-1��
��3������Ksp= c(Ca2+)��c(CO32��)=2.8��10−9��֪c(Ca2+)��Ksp/c(CO32��)��2.8��10−9/2.8��10 -5��1��10-4mol/L����������CaCl2��Һ����СŨ��Ϊ1��10-4mol/L��2��2��10-4mol/L


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2013?�Ͳ�һģ�������û�ѧ��Ӧԭ�������֪ʶ�о�Ԫ�ؼ��仯��������ʣ�
��2013?�Ͳ�һģ�������û�ѧ��Ӧԭ�������֪ʶ�о�Ԫ�ؼ��仯��������ʣ�| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� �¶� |
����̿��mol�� | NO��mol�� | E��mol�� | F��mol�� |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
2- 3 |
- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����������ѧ����8���¿���ѧ�Ծ��������棩 ���ͣ������
(12��)ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯���������
(1)�õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ��(ϵ����˳�����ڴ������)
___ C+ ___ KMnO4+ ____ H2SO4��____CO2��+ ____MnSO4 + ____K2SO4+ ____H2O
(2)����̿�ɴ���������Ⱦ��NO����2 L�ܱ������м���NO�ͻ���̿�������ʣ�����������E��F�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ������±���
|
���� n/mol T/�� |
����̿ |
NO |
E |
F |
|
��ʼ |
2.030 |
0.100 |
0 |
0 |
|
T1 |
2.000 |
0.040 |
0.030 |
0.030 |
|
T2 |
2.005 |
0.050 |
0.025 |
0.025 |
�������ϱ����ݣ�д��NO�����̿��Ӧ�Ļ�ѧ����ʽ ��
�ڸ���������Ϣ�жϣ��¶�T1��T2�Ĺ�ϵ�ǣ�����ţ� ��
a��T1��T2 b��T1��T2 c�����Ƚ�
(3)CO2�������������������գ�����0.4molCO2������200ml 3mol/LNaOH��Һ������ȫ���գ���Һ������Ũ���ɴ�С��˳��Ϊ��
(4)CO����������ȼ�ϵ�ص�ȼ�ϣ�ij������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ��õ���� Li2CO3 �� Na2CO3 �������λ����������ʣ� CO Ϊ����ȼ���������� CO2 �Ļ����Ϊ������ȼ�����Ƶ��� 650 ���¹�����ȼ�ϵ�أ���������Ӧʽ:2CO + 2CO32�� =4CO2 +4e�� �� ������Ӧʽ�� ������ܷ�Ӧʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com