
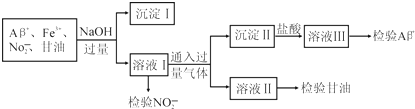
| A. | 通入的过量气体可能是CO2 | |
| B. | 分离出沉淀Ⅰ的操作名称是过滤,利用沉淀Ⅰ可检验出Fe3+ | |
| C. | 若向溶液Ⅲ中先加足量NH4F后再加氨水可以检验Al3+ | |
| D. | 用酸性KI溶液检验NO2-离子的离子方程式为2NO2-+2I-+4H+═2NO+I2+2H2O |
分析 根据微粒性质或特性解答,Al3+遇强碱先产生沉淀后溶解;Fe3+与碱产生红褐色沉淀;NO2-在酸性条件下具有强氧化性,可氧化I-;甘油可与新制氢氧化铜产生绛蓝色沉淀.
A:利用Al(OH)3不溶于弱酸弱碱
B:利用过滤可分离溶液中的不溶性杂质;利用Fe(OH)3不溶于碱
C:抓住题目提供的信息,注意利用
D:利用氧化还原和三大守恒解答
解答 解:流程整体分析:Al3+、Fe3+、NO2-、甘油分子,加入过量NaOH,得到沉淀ⅠFe(OH)3,滤液Ⅰ是 NaAlO2其它不变,通入CO2可产生Al(OH)3沉淀Ⅱ,向其中盐酸后,得到溶液Ⅲ为AlCl3,
A:Al(OH)3不溶于弱酸弱碱,所以要产生沉淀Ⅱ,可通入CO2,所以A正确;
B:分离溶液中的不溶性杂质,用过滤;根据物质性质,题目中给的粒子中与过量NaOH能生成沉淀,只有Fe3+所以B正确;
C:根据题目提供的信息Al3++6F-═[AlF6]3-,向溶液Ⅲ为AlCl3中先加足量NH4F会形成络合离子[AlF6]3-,溶液中铝离子浓度明显减少或反应完全,再加入足量氨水,不会有白色胶状氢氧化铝沉淀生成,即无明显现象看到,因此无法检验Al3+,所以C不正确;
D:酸性条件下NO2-可氧化I-成I2,根据三大守恒( 电荷守恒、电子守恒、原子守恒),可写出离子方程式2NO2-+2I-+4H+═2NO+I2+2H2O,所以D正确.
点评 较简单,但需牢记物质的特性,并抓住题目提供信息,是解答此类题目关键.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属元素只能形成共价化合物 | |
| B. | 在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 离子化合物可能含有共价键原子核之间的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 卤化银的溶解度随核电荷数的增加逐渐增大 | |
| C. | 单质与水反应均可表示为X2+H2O═HX+HXO | |
| D. | 随核电荷数的增加,X-的半径递增,还原性递减 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中元素一定呈化合态 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 某纯净的物质不是化合物就是单质 | |
| D. | 由同种分子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用可再生能源,用超临界二氧化碳替代有机溶剂,注重原子经济性,采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 13C与14C属于同一种元素,它们互为同位素 | |
| C. | 通过化学变化可以实现235U与238U的相互转化 | |
| D. | 同位素示踪法是研究化学反应历程的手段之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{WV{N}_{A}}{22.4M}$ | B. | $\frac{MV{N}_{A}}{22.4W}$ | C. | $\frac{WV}{22.4M}$ | D. | $\frac{MV}{22.4W}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
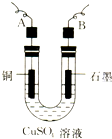 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器如下图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器如下图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com