
【题目】用1000g溶剂中所含溶质的物质的量来表示的溶液浓度叫质量物质的量浓度,其单位是mol/kg。5mol/kg的硫酸的密度是1.29g/cm3,则其物质的量浓度是( )
A. 3.56mol/LB. 4.33mol/LC. 5.00mol/LD. 5.23mol/L
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,反应HX(g)![]() 1/2H2(g)+ 1/2X2(g) 的平衡常数为0.1。若将等物质的量的H2(g)和X2(g)通入体积为1L的密闭容器中,在该温度下HX(g)的最大产率接近于( )
1/2H2(g)+ 1/2X2(g) 的平衡常数为0.1。若将等物质的量的H2(g)和X2(g)通入体积为1L的密闭容器中,在该温度下HX(g)的最大产率接近于( )
A. 83% B. 17% C. 5% D. 33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y和Z之间的有__________________。
(3)Y和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。

(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钠、氯及其化合物间有如下转化关系,
请按要求填空:
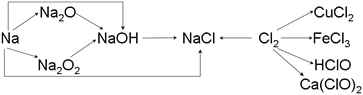
(1)实验室中金属钠通常保存在_______中,一小块金属钠投入水中反应的化学方程式是________________。
(2)Na2O2常用于呼吸面具中,有关反应的化学方程式为_____________________________,_________________________________。
(3)新制的氯水滴入紫色石蕊试液中,观察到的现象是___________________________。
请写出氯气与水反应的化学方程式_______________________________。
(4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出木炭与浓硫酸反应的化学方程式____。
为了验证产物中的二氧化碳气体,甲、乙两同学分别设计如下实验(已知Br2+2H2O+SO2=H2SO4+2HBr):
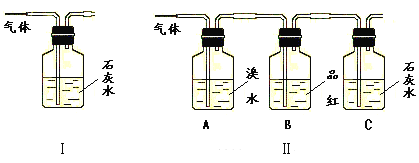
请回答下列问题:
(1)能否根据Ⅰ装置中石灰水变浑浊的现象说明产物中一定有二氧化碳气体?___,理由是____。
(2)Ⅱ装置中A的作用是___;B的作用是___。
(3)根据B中品红__,C中产生___,说明产物中一定有二氧化碳气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室由间苯二酚合成2-硝基-1,3-苯二酚的原理如下:

已知:
物质 | 间苯二酚 | 2-硝基-1,3-苯二酚 |
熔点 | 109~112℃ | 84.85℃ |
沸点 | 276.5℃ | 234℃ |
溶解性 | 易溶于水 | 微溶于水 |
相对分子质量 | 110 | 155 |
实验药品:间苯二酚、浓硫酸(98%)、混合酸(由浓硝酸和浓硫酸按2:3的体积比混合而成)、尿素等。
实验步骤:
Ⅰ.称取2.7g间苯二酚粉末,放入100mL锥形瓶中,再加入13mL浓硫酸,同时充分搅拌,反应放热,立即生成白色磺化物。
Ⅱ.当反应物冷却后,用滴管滴加预先用冰水浴冷却好的混合酸,同时进行搅拌,并使反应温度不超过30℃.将生成的黄色粘稠状液体在室温下放置15min,再用7.5mL带有碎冰的冷水稀释,保持温度在50℃以下,得到红褐色的稠状液体。
Ⅲ.将反应液转移至250mL烧瓶中(如右下图所示,夹持和加热装置均已略去),再加入0.1g尿素,进行蒸馏,蒸馏液通过抽滤,洗涤干燥后,可得到橘红色片状晶体粗品。

试回答下列问题:
(1)进行产物蒸馏时,冷却水应从______(填“a”或“b”)口进入。
(2)实验过程中,温度控制在较低温度下进行的原因可能是:______。
(3)实验过程中配制混酸的正确操作是:______。
(4)加入尿素,其目的是使多余的硝酸和尿素反应而被除去。其中反应之一的化学方程式为:2CO(NH2)2+6HNO3=NH4NO3+8NO↑+2CO2↑+5H2O,若生成1.12LCO2(标准状况下)时,则转移的电子数为______。
(5)对粗品进行(方法)可提高产品纯度。若干燥后称量所得产品的质量为 2.1g,则其产率为______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(s)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的
2Z(g)一定达到化学平衡状态的
①容器中气体的密度不再发生变化 ②Y的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成2mol Z,同时消耗2mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2NO2(红棕色)![]() N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到了平衡状态
B. b点对应的时刻改变的条件是将注射器的活塞向外拉
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com