
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变反应物浓度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变反应的限度 | |
| D. | 催化剂不能控制化学反应的限度 |
分析 在一定条件下的可逆反应经过一定的时间后,正、逆反应速率相等,反应物和生成物的浓度不再发生变化,这种表面上静止的“平衡状态”就是这个可逆反应所能达到的限度.
解答 解:A、可逆反应不论反应到什么程度,都会含有所有反应物和所有生成物,即会达到一定的限度,不同的化学反应,限度可能不同,故A正确;
B、一个可逆反应达到化学平衡状态后,当条件反应物浓度改变时,原来的化学平衡状态就会被破坏,并在新的条件下建立新的化学平衡状态,以通过改变反应物浓度来控制化学反应的限度,故B正确;
C、可逆反应达到什么样的限度,与反应时间的长短无关,何时达到化学平衡状态,由反应本身及反应速率有关,所以不可以通过延长化学反应的时间来改变化学反应的限度,故C错误;
D、催化剂只改变反应速率,不改变反应限度,故D正确.
故选C.
点评 解答该题要注意以下几点:
1、化学平衡状态是可逆反应在一定条件下进行的最大限度;
2、任何可逆反应的进程都有一定的限度,只是不同可逆反应的限度不同罢了;
3、温度、浓度、气体的压强等都能使化学反应速率发生改变,所以化学反应的限度可用通过改变条件而改变.


科目:高中化学 来源: 题型:解答题

| 物质 | 甲 | 乙 | 丙 |  |
| 微观示意图 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
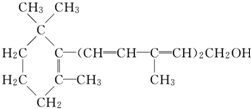
| A. | 维生素A是一种醇 | |
| B. | 维生素A的一个分子中含有三个碳碳双键 | |
| C. | 维生素A的一个分子中有33个氢原子 | |
| D. | 维生素A不能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:2Fe(OH)3-6e-+10OH-═2FeO42-+8H2O | |
| C. | 放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| D. | 放电时正极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
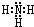 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、HD、C3H8 | B. | PCl3、CO2、H2SO4 | C. | SO2、BN、P2O5 | D. | CCl4、Na2S、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
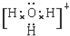 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是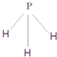 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 30 | 1mL蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com