
【题目】下列判断正确的是( )
A.若NaA、NaB溶液的pH分别为9和8,则酸性一定是HA<HB
B.FeCl3溶液蒸干得FeCl3固体,Na2CO3溶液蒸干得Na2CO3固体
C.中和pH和体积均相同的盐酸和醋酸溶液,后者消耗NaOH的物质的量多
D.因Fe2++2H2O![]() Fe(OH)2+2H+,为抑制水解,配制Fe(NO3)2溶液时需将Fe(NO3)2溶解在稀HNO3中
Fe(OH)2+2H+,为抑制水解,配制Fe(NO3)2溶液时需将Fe(NO3)2溶解在稀HNO3中
【答案】C
【解析】
A项、没有给出NaA、NaB溶液的浓度,所以不能根据NaA、NaB溶液的pH大小判断HA和HB的酸性强弱,故A错误;
B项、FeCl3在溶液中水解生成Fe(OH)3和HCl,加热HCl挥发,促进水解平衡正移,导致FeCl3溶液蒸干得Fe(OH)3固体,碳酸钠在溶液中水解生成碳酸氢钠和氢氧化钠,碳酸氢钠和氢氧化钠都是难挥发物质,蒸发时,二者浓度变大又重新生成Na2CO3,所以蒸干得到的仍是碳酸钠固体,故B错误;
C项、pH相同的盐酸和醋酸溶液中氢离子浓度相同,由于醋酸是弱酸,部分电离,所以醋酸的浓度大,而且盐酸和醋酸的体积也相同,所以醋酸的物质的量多,所以醋酸中和的氢氧化钠多,故C正确;
D项、硝酸具有强氧化性,配制Fe(NO3)2溶液时将Fe(NO3)2溶解在稀HNO3中,亚铁离子被氧化为铁离子,故D错误;
故选C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】元素X、Y、Z位于不同短周期,原子序数依次增大。X、Z同主族,二者的原子序数之和是Y原子序数的两倍,主族元素W的原子最外层电子数比电子层数多4。下列说法不正确的是( )
A.简单离子半径:W>Z>X
B.X、Y、Z都能与W组成离子化合物
C.X、Y组成的化合物可与W单质反应
D.Q是Z、W组成的化合物,1 molQ中约含有6.02×1023个阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完成下列反应的化学方程式:(注明反应的条件,并配平方程式)
①实验室制乙炔____;
②向苯酚钠溶液中通入少量的二氧化碳气体____;
③甲苯与氯气在光照条件下反应生成一氯取代产物____;
(2)有机物A的结构简式为CH3CH2CH(CH3)CH(CH3)C(CH3)3
①若A是单烯烃与氢气加成后的产物,则该单烯烃可能有____种结构(不考虑立体异构);
②若A是炔烃与氢气加成后的产物,则该单烯烃可能有____种结构;
③C5H12O的同分异构体中属于醇类且能被氧化成醛的有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 水解的说法错误的是( )
水解的说法错误的是( )
A.在稀溶液中,水解达到平衡时,无论加![]() 饱和溶液还是加水稀释,平衡均向右移动
饱和溶液还是加水稀释,平衡均向右移动
B.浓度为![]() 和
和![]() 的两种
的两种![]() 溶液,其他条件相同时,
溶液,其他条件相同时,![]() 的水解程度前者小于后者
的水解程度前者小于后者
C.其他条件相同时,同浓度的![]() 溶液在50 ℃和20 ℃时发生水解,50 ℃时
溶液在50 ℃和20 ℃时发生水解,50 ℃时![]() 的水解程度比20 ℃时的小
的水解程度比20 ℃时的小
D.为抑制![]() 的水解,更好地保存
的水解,更好地保存![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图①可表示将SO2气体通入溴水时pH的变化
B. 图②表示KNO3的溶解度曲线,a点是80 ’C的KNO3的不饱和溶液
C. 图③表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 图④表示室温下,0.100 mol/L NaOH溶液分別滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.001 mol·L-1盐酸滴定0.001 mol·L-1 NaOH溶液的滴定曲线
B. 图2表示从能量角度考虑,石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中含大量Al3+
D. 图4所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___mol·L-1(填精确数值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
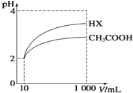
稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”,下同)醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为![]() 的下列四种溶液:
的下列四种溶液:
①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④
溶液 ④![]() 溶液
溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的![]() 浓度最小的是______。(均填序号)
浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是__________,![]() 的水解平衡常数
的水解平衡常数![]() ______
______![]() 。(已知碳酸的电离常数
。(已知碳酸的电离常数![]() )
)
(3)向③中通入少量氨气,此时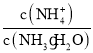 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途.
![]() 一
一![]() 如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和
如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和![]() 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:
![]()
![]() 中所含的化学键有 ______ .
中所含的化学键有 ______ .
(2)氯化亚铜![]() 的制备过程是:向
的制备过程是:向![]() 溶液中通入一定量
溶液中通入一定量![]() ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
![]() 二
二![]() 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知![]() 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______ ![]() 填元素符号
填元素符号![]() .
.
(2)请在上图中把![]() 结构中的化学键用短线“--”表示出来.______
结构中的化学键用短线“--”表示出来.______
(3)往浓![]() 溶液中加入过量较浓的
溶液中加入过量较浓的![]() 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的![]() 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色![]() 晶体.实验中所加
晶体.实验中所加![]() 的作用是 ______ .
的作用是 ______ .
(4)![]() 晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是
晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是![]() 杂化的原子是 ______ .
杂化的原子是 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com