
25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH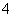 )分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
)分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
科目:高中化学 来源: 题型:
如图所示, 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路(未闭合K)后发现
为电镀槽。接通电路(未闭合K)后发现 上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
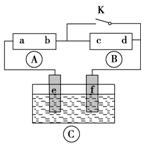
A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料的铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)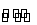 2NH3(g)(正反应为放热反应),下列说法中正确的是( )
2NH3(g)(正反应为放热反应),下列说法中正确的是( )
A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡的小
B.达到平衡后,升高温度,既加快了正、逆反应速率,又提高了NH3的产率
C.达到平衡后,缩小容器体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率
D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应速率减小了
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的温度和压强通常控制在约500℃以及20 MPa~50 MPa的范围,当进入合成塔的N2和H2的体积比为1∶3时,经科学实验测定,在相应条件下N2和H2反应所得氨的平衡浓度(体积分数)如下表所示:

而实际上从合成塔出来的混合气体中含有氨约为15%。
请回答下列问题:
(1)298 K下合成氨时,每生成1 mol 氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在的条件下进行反应,测得反应放出的热量总小于92.4 kJ,其原因是______________。
(2)实际上从合成塔出来的混合气体中氨的体积分数小于理论值的根本原因是_______________。
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应未达到平衡状态
(3)若工业生产中N2和H2按投料比1∶2.8的比例进入合成塔,那么转化率较大的应该是_________,采用此投料比的原因是______________,
若从合成塔出来的混合气体中氨的体积分数仍为15%,则N2和H2的转化率之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.在Na2S溶液中滴入酚酞试液,呈红色 B.硫酸铵溶液显酸性
C.一切钾盐、钠盐、硝酸盐都不发生水解 D.醋酸盐溶于水能发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学清洗银镜实验后试管内壁上的银并探究其中的反应原理,进行下列实验。
(1)用稀硝酸可以清洗试管内壁上的银,反应的化学方程式为______________。
(2)为消除(1)中所产生的污染问题,改为如下实验。
| 实验编号 | 操作 | 现象 |
| Ⅰ |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a |
①该同学由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能性。他的操作及现象是:取实验Ⅰ所得液体于试管中,______________;
②经查阅资料,发现:实验Ⅰ中银镜溶解后经一系列反应,最后产物为Ag,但是因为颗粒很小(直径在1~100 nm 间)分散在液体中,肉眼无法识别。该同学设计实验,证实了a中存在直径在1~100 nm间的颗粒。他的操作及现象是:________________;
③写出实验Ⅰ的化学方程式:______________。
(3)进一步探究银的化合物在H2O2分解反应中的作用,进行如下实验。
| 实验 编号 | 操作 | 现象 |
| Ⅱ |
| 振荡,溶液无明显现象 |
| Ⅲ |
| 剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体 |
①实验Ⅱ的目的是____________;
根据实验Ⅲ的现象提出假设:
假设1:Ag2O在H2O2分解反应中作氧化剂;
假设2:Ag2O在H2O2分解反应中作催化剂。
②若假设1成立,请写出该反应的化学方程式:______________;
③结合所给试剂,请设计一个简单的实验证明假设1,并将表格填写完整。
可选试剂:1 mol·L-1盐酸、0.1 mol·L-1氨水、1 mol·L-1 NaOH溶液
| 实验步骤和操作 | 实验现象及结论 |
| 取3 mL 10% H2O2在试管中,加入少量Ag2O,充分反应后,__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是( )
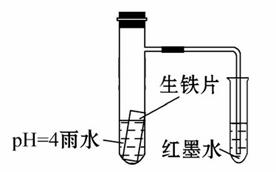
A.生铁片中的碳是原 电池的阳极,发生还原反应
电池的阳极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为:O2+2H2O+4e-====4OH-
D.具支试管中溶液pH逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com