
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
分析 A.根据n=$\frac{V}{{V}_{m}}$计算甲烷的物质的量,根据n=$\frac{m}{M}$计算水的物质的量,CH4与H2O每个分子都含有10个电子数,再根据N=nNA计算电子数
B.镁原子失去2个电子形成镁离子,根据nn=$\frac{m}{M}$计算镁的物质的量,再根据N=nNA计算失去的电子数;
C.使用物质的量必须指明具体的物质或化学式、微粒,盐酸溶质粒子为氢离子和氯离子,0.5mo1/L盐酸未告诉体积,无法计算;
D.CO气体所处的状态不一定是标准状况.
解答 解:A.在标准状况下,22.4LCH4的物质的量为1mol,18gH2O的物质的量为:$\frac{18g}{18g/mol}$=1mol,CH4与H2O每个分子都含有10个电子数,所以在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA,故A正确;
B.2.4g金属镁变为镁离子时失去的电子数为:$\frac{2.4g}{24g/mol}$×2×NAmol-1=0.2NA,故A错误;
C.1molHCl气体中的粒子数,粒子指代不明确,盐酸溶质粒子为氢离子和氯离子,0.5mo1/L盐酸未告诉体积,无法计算,故B错误;
D.CO气体所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,无法计算其物质的量,不能比较二者所含电子数,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-1mol/L | B. | 1×10-7mol/L | C. | 1×10-11mol/L | D. | 1×10-13 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴化铝(无色晶体,熔点98℃,熔融态不导电) | |
| B. | 碳化铝(黄色晶体,熔点2200℃,熔融态不导电) | |
| C. | 氟化铝(无色晶体,熔融时或溶于水时破坏了相同的作用力) | |
| D. | 五氟化钒(无色晶体,熔点19.5℃,易溶于乙醇) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH计(也叫酸度计)不可能用于酸碱中和滴定终点的判断 | |
| B. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”,聚碳酸酯是一种新型无机非金属材料 | |
| C. | 麦芽糖是高分子化合物,可以发生银镜反应,但是其水解产物不能发生银镜反应 | |
| D. | 石油在催化剂和加热条件下的结构重整是制取苯、甲苯等芳香烃的一种重要方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
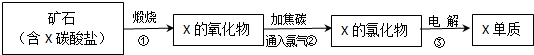
 $→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$
$→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$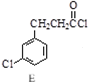 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$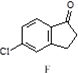
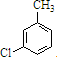 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.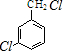 +3NaOH$→_{催化剂}^{高温、高压}$
+3NaOH$→_{催化剂}^{高温、高压}$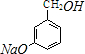 +2NaCl+H2O.
+2NaCl+H2O. (任写一种).
(任写一种). .
.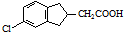 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: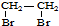
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com